 研发追踪
研发追踪
 Insight数据库
Insight数据库  2023-07-24
2023-07-24
 4708
4708
7 月 20 日,第一三共宣布,其在研新药 quizartinib(VANFLYTA®)获 FDA 批准上市,用于治疗 FLT3-ITD 突变新诊断急性髓细胞白血病(AML)成人患者。
quizartinib 成为首个也是当前唯一一个获 FDA 批准用于治疗 FLT3-ITD 阳性 AML 的 FLT3 抑制剂,且涵盖新诊断 AML 未移植患者的诱导、巩固以及维持治疗三个阶段。这也是第一三共肿瘤管线中,第 3 款获 FDA 批准的创新药。

来自:第一三共官网
此次获批基于 QuANTUM-First 研究结果,已发表在柳叶刀期刊上。
这是一项随机、双盲、安慰剂对照研究,共纳入了 539 名新诊断 FLT3-ITD 阳性 AML 患者,且按 1:1 被随机分配接受 quizartinib 或安慰剂联合标准诱导和巩固治疗后,继续接受单药维持治疗。
结果显示,与安慰剂相比,quizartinib 组患者的死亡风险降低了 22%(HR = 0.78;95% CI: 0.62-0.98),两组患者的完全缓解(CR)率相似,不过,quizartinib 组患者 CR 的中位持续时间为 38.6 个月,而安慰剂组仅为 12.4 个月。
QuANTUM-First 研究结果


来自:Insight 数据库网页版(下同)
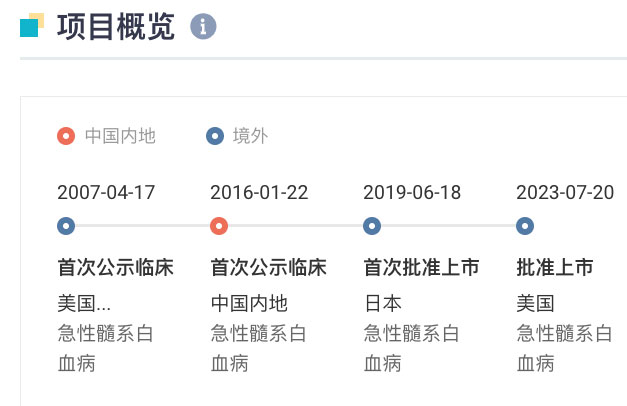
quizartinib 是一款口服、具选择性的 2 型 FLT3 抑制剂,据 Insight 数据库显示,最早于 2019 年 6 月在日本获批上市,用于治疗携带 FLT3-ITD 基因变异的复发/难治性(R/R)急性骨髓性白血病(AML)成人患者。在国内,于 2016 年 1 月首次启动临床,当前正处于 III 期临床阶段。
Quizartinib 全球项目开发关键节点

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-12-15
2025-12-15
 82
82

 研发追踪
研发追踪
 药渡
药渡  2025-12-15
2025-12-15
 78
78

 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-12-15
2025-12-15
 74
74