 产业资讯
产业资讯
 艾美达医药咨询
艾美达医药咨询  2023-09-13
2023-09-13
 2505
2505
“iMeta视野” :
艾美达医药咨询分享内/外部高质量行业会议观点的专栏,与行业人士一同开阔视野、激荡思维。
继港交所开放门槛拥抱生物医药企业上市之后,香港引导支持生物经济发展又有新动作。据多位行业专家人士近期在公开会议上透露,香港正在酝酿成立类似美国FDA的独立药品监督管理机构,简称“港版FDA”。
“香港生物科技之父”、香港生物医药创新协会会长卢毓琳,香港交易所联席营运总监及股本证券主管姚嘉仁以及中国医药创新促进会促进会执行会长宋瑞霖等认为,成立“港版FDA”一方面可以促进科研成果向产业转化,为香港吸引和留住优质生物医药创科企业及人才,拉动当地生物医药经济,另一方面可以作为全球新药进入中国的“门户”、中国新药走向海外的“前站”,为国内本土生物医药产业与世界的互通和发展提供有利支持。
9月11日,香港生物医药创新协会发布《致香港特别行政区行政长官建议书 – 构建香港生物科技创新产业生态系统》(以下简称“《建议书》”),其中对比了新加坡和香港两地过去数十年发展生物经济的重要规划和里程碑,并详细阐述了香港成立“港版FDA”的重要意义和现实条件。
根据《建议书》,由于香港未设有独立的医药监督管理机构,在目前的医药监管制度下,一款新药赴港上市前必须先拿到规定范围内其他国家和地区内的上市注册证(如欧洲、美国、中国内地等),才能向香港卫生署申请上市审查,这一流程至少耗时2年时间。
而若根据建议成立港版FDA,设置及审查程序简化后,参考美国 FDA 及欧盟EMA,新药从Ⅲ期临床结果公布到审批上市则只需8-10个月。药企从研发到上市的效率大幅提升,成本大幅降低。
回顾全球公认的药品审批机构的成立和发展,美国FDA、欧洲EMA和中国NMPA均对当地生物医药经济发挥了显著的产业指导和带动作用。从临床试验的审批、新药注册与审批到生物科技相关产品及系列生产的监督与监测,监管标准的设立引导着新药和生物科技产品的安全性、有效性,推动着产业的创新发展。
《建议书》认为,在香港设立独立的医药监管机构,可以从顶层设计上明确具国际标准的注册与监管法规、准入标准、风险评估,以及保持全球透明的数据与信息共享,以此提升本港医药注册与临床试验的安全性与有效性,“有助于加速海内外药企入港开展临床试验,助推香港加速成为国际临床试验中心,进一步推动香港生物经济产业的可持续发展”。
中国医药创新促进会促进会执行会长宋瑞霖不久前则对外谈到,“港版FDA”成立后有望与粤港澳大湾区形成紧密互动,获“港版FDA”批准上市的新药和器械产品,或可在大湾区的临床机构开展临床试验,并加速进入中国市场。
值得一提的是,自2015年NMPA审评审批制度系列改革以来,中国内地政府部门对于加强创新药械发展创新性和进行国际交流的意愿日益强烈。2018年,国务院先后赋予海南临床急需进口医疗器械、药品使用的审批权,为海外创新药品和器械进入国门打开了一扇窗口,乐城先行区的医疗机构可以使用国外已上市、国内未上市的创新药械。这一特区“先试先行”政策的出台,正是为了进一步缩小创新药械在海内外上市的“时间差”,并促进本土药械追赶国际水平持续创新发展。
附:
《致香港特别行政区行政长官建议书 – 构建香港生物科技创新产业生态系统》:
[香港生物医药创新协会 2023年9月11日]
第一、建议书背景与目的
香港很早便已开始佈局生物经济产业,回归祖国后至今,香港特区政府亦通过各项政策来引导生物经济产业的发展,且颇现成效。随著生物经济产业成为全球主流国家或地区的战略性产业之一,加速发展生物经济产业成为国家/地区的新的经济增长点或核心引擎,已经成为主流。
承2022年本会《致香港特别行政区行政长官建议书 – 构建香港生物科技创新产业生态系统》,本会希望是份建议报告能在此基础上,进一步探索当下发展香港生物经济产业所需之战略环节,以此来推动香港生物经济产业的可持续发展!
第二、香港的生物经济体系现状
1. 香港的制度优势
1)香港的发展依托于“一国两制”的制度优势,给予了香港在决策上的自主权与自由发挥的空间。
2)《国家十四五规划纲要》明确指出要大力发展包括生物技术产业在内的九大战略性新兴产业,而《“十四五”生物经济发展规划》作为国家首部生物经济五年规划,首次为生物经济产业的发展制定了五年内发展的详细目标,标志着国家对生物经济产业发展的重视。
3)香港特区政府创新科技及工业局 于2022年12月公佈《香港创新科技发展蓝图》,为未来5至10年的香港创新科技(创科)发展制订清晰的发展路径和系统的战略规划。这是一份关于香港创科产业发展的第一个5-10年规划,为制定构建香港生物经济体系5-10年规划奠定了政策基础。
4)国务院发布《河套深港科技创新合作区深圳园区发展规划》,规划至2025年,展望2035年,成为香港发展生物经济产业的参考与指导性文件。
2. 香港的地理位置
香港位于亚洲中心,是粤港澳大湾区的重点城市,一直被称为“进入中国内地的门户”,是国家链接世界的桥樑。
1. 基础设施
香港科技园、港深创新及科技园、数码港、新田科技城等适用生物经济产业发展的基础设施稳步推进中,且初现成效。
2. 香港的国际经验
1)基础科研水准世界领先:根据香港大学教育资助委员会公佈的“2020年研究评审工作”报告显示,香港有45%的学术研究被国际专家认可为“国际卓越”水准(三星及以上水准),25%被评为“世界领先”水准(四星水准)。这为香港生物经济体系的可持续发展奠定了强大的科研与人才基础。
2)临床试验数据受国际认可:香港是全球首地,临床试验数据同时广泛获国家药品监督管理局、美国食品及药品监督管理局和欧洲药物监督管理局等国际权威药物管理单位认可作药物注册用途。此外,香港四家医疗机构包括养和医院、威尔斯亲王医院、玛丽医院、香港眼科医院直接成为国家药品监督管理局认定可接受药品注册申请人委託,开展经国家药品监督管理局批准的药物临床试验。
3)专业服务享誉国际:香港具备专业且成熟的知识产权保护体系、独立的法律体系、相较于其它国家或地区的低税率、多元的语言及文化,丰富的人才资源储备等,这为生物经济产业的全球交流与合作奠定了卓越的营商环境基础。
4)亚洲领先生物科技融资中心:香港交易所上市主管伍洁旋在9月5日举行的香港交易所生物科技峰会时表示,截至2023年8月底,共119家生物经济相关产业在港上市,当中60家通过第十八A章上市,从而助力香港成为亚洲领先的生物科技融资中心。
香港这些得天独厚的经验优势使其成为中国内地链接国际生物经济市场的桥樑,亦为香港构建可持续发展的生物经济体系奠定庞大的基础。
第三、实现香港生物经济体系的可持续发展之路
本会所阐述之可持续发展的香港生物经济体系的战略举措包括:一、政府主导:优化现行政策,尤其是现有资助政策;制定阶段性行之有效的发展规划;二、基础设施的完善,即:建立港版FDA及本港第三所医学院。
一、政府主导:制定阶段性行之有效的发展规划;优化现行政策
1. 制定阶段性行之有效的发展规划 - 以新加坡为例
新加坡为发展生物经济产业,制定出一整套行之有效的多个“五年期规划”,步步推进,几十年内发展成 “大士生物医药园 制造 + 启奥生物医药园 研发”的产业格局,吸引包括葛兰素史克、默沙东、艾伯维、诺华、辉瑞、罗氏、赛诺菲、安进等数百家国际药厂入驻,一跃成为亚洲发展最快的生物经济产业集群。

新加坡与香港生物经济产业重要里程碑对比图
上图为本会综合各方资料后列明的“新加坡与香港生物经济产业相关之重要里程碑对比图”(下称“对比图”),新加坡政府于2000年确定生物经济产业为国家战略,并提出十五年生物医学科学计划作为中长期战略,剑指“打造全球医药与医疗结束制造基地”,在接下来的每一个五年(2000-2005年、2006-2010年、2011-2015年)裡,先后针对不同核心环节,稳步推进多个“短期五年计划”,并达到显著成效。2016-2020年及2021-2023分别提出研究、创新与企业2020计划“RIE2020”及研发、创新与企业2025计划“RIE2023”,针对当下不同时期的技术重点,来巩固本国生物经济成绩。
由此可见,以长远战略为指导,多个短期战略为辅助,来制定行之有效的发展规划,是发展本国/地区生物经济产业中顶层设计环节裡,不可或缺的一环。这有助于生物经济产业产、学、研、官、资及时就当下行业发展的现状与需求进行调整、升级,稳步推进,促进生物经济产业的长远发展。
2. 优化现行政策
1)增加生物经济产业的相关持份者在各项政府级别的政策咨询会、核心决策层、科学顾问会的权重。
战略决策层面的专家引进与储备,有助于全面掌握本港当下生物经济发展现状,为制定符合现时发展的产业策略奠定战略人才基础。例如,本会会长卢毓琳教授曾参与多次香港特区政府行政长官施政报告咨询会(创新科技相关)发现,在上百位出席的各行业顾问当中,代表香港生物经济产业的学者、企业家等仅有寥寥几位,其馀全部为创新科技其它领域代表,发声力量的比例失衡或未能获得足够的机会以全方面反馈香港生物经济产业现状及诉求。
2)优化政府资助政策的权重与执行方式,鼓励大学/科研机构与企业深度合作,让企业承担更多的责任。
政府现行的提升创科产业的资助政策按四大类责任权重划分,包括:以大学为主要责任体、以企业为主要责任体、以科研机构为主要责任体、以个人为主要责任体。鲜有创科产业链上、中、下游有效沟通的机制与合作内容,而相关“促进科学成果转化水平”类资助政策的主要责任与决定权则集中在产业上游基础科研领域的高校/科研机构手中,中下游参与技术转移与商品化的企业的权重相对被动。实时优化有助于促进产业合作的资助政策,调整相关资助政策的权重比例与责任,有助于促进产业链上中下游高效沟通,提升本港科学成果转化的水平。
3)善用香港现有基础设施与强势的服务生态优势,利用政策巩固优势,引导它们为生物经济产业服务,从而为香港发展生物经济产业的可持续发展营造良好的营商环境。
我们从对比图中可以看到,新加坡政府从1985年开始佈局本国生物经济产业后,围绕在顶层制度设计、政府资助措施、基础设施、“吸引+培养”人才、体系化的知识产权制度等内容,来为本国生物经济体系发展打造良好的生态环境,以此巩固本国生物经济产业的发展。
如前文所述,香港拥有备受国际认可的法律体系、专利、金融等服务体系,相较于其它国家或地区的低税率、多元的语言及文化,丰富的人才资源储备等明显的优势。引导性措施除了顶层制度设计、资助政策与基础设施外,还应包括但不限于:
专利法律的力度:营造良好的研发与转化环境
税务环境与营商成本的改良,推动全产业链企业入港
人才战略,以此吸引海外与培养本港卓越人才等
二、基础设施
1. 在香港设立独立的医药监督管理机构(下称“港版FDA”)
医药监管机构对于本国/本地区生物经济体系的发展有著十分关键的作用,本会综合不同国家或地区设立的医药监督管理机构来看,该监管机构的功能包括但不限于临床试验的审批;新药注册与审批;生物科技相关产品及系列生产的监督与监测,以确保生物科技产品的安全性与有效性;此外,医药监督管理机构亦充当本国/本地区生物经济产业指导性角色。
1)港版FDA 的定位
港版FDA作为香港独立的审评机构,应严格遵从香港“一国两制”的制度框架,维持与国际接轨的基础,充分发挥香港的优势,应本港生物经济发展的需要而佈局。既有助于祖国药企通过香港走出国门,又能协助海外药企通过香港进入内地市场,从而真正意义上地发挥出香港链接祖国与世界市场的战略意义。
2)港版FDA的功能与作用
简化新药入港注册与审批程序,发挥香港临床试验数据受全球认可的优势,连通内地与海外生物医药产业屏障,以吸引海内外生物医药企业赴香港布局。
本港现时并无医药监督管理机构,海外新药入港需根据香港药剂业及毒药管理局《新药剂或生物元素药剂制品注册申请指南》(下称“申请指南”)引述之要求,取得国际上权威的两家或以上的监管机构的药证后,才可入港接受香港卫生署第二层审查,获批后方可在港上市。
根据“申请指南”引述,香港对于新药在港注册的条件依然严谨:

备注:在生物经济产业实际运作过程中,很多国家/地区,尤其是内地的临床试验数据/药物依然无法得到以上“一组”所列国家或地区的认可,当中所消耗的时间、精力与成本往往让药企对香港望而却步,长此以往,不利于香港生物经济产业的发展。
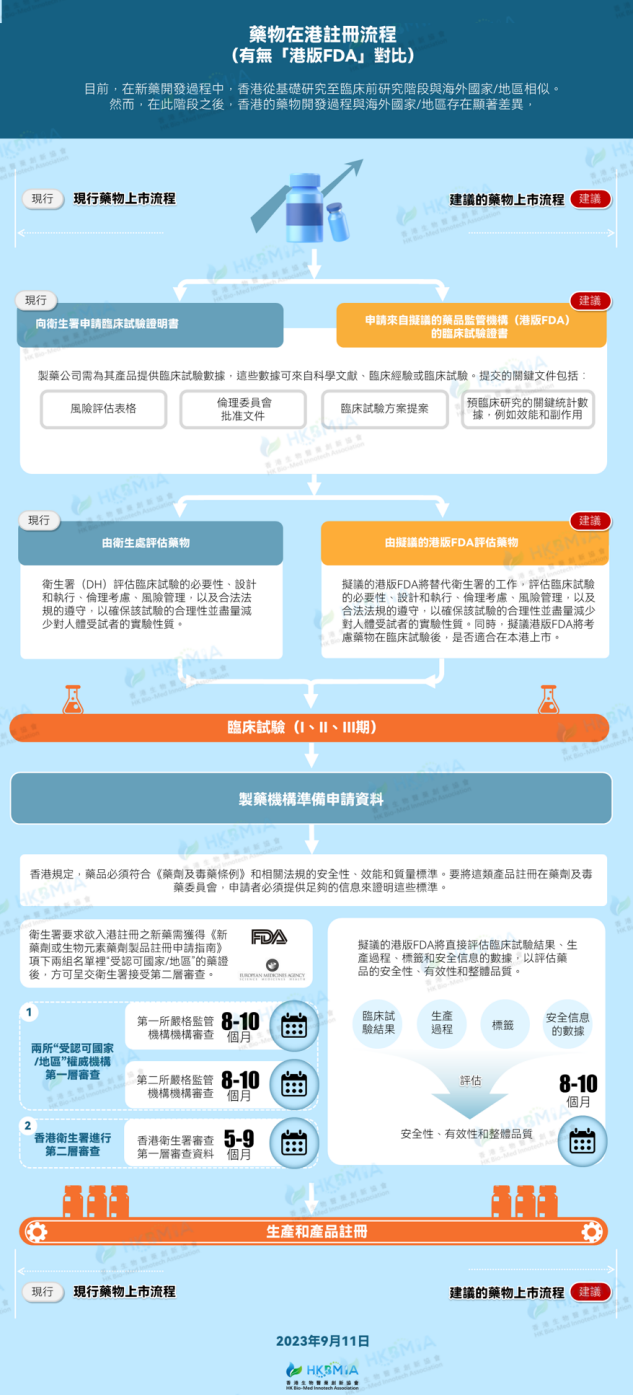
有无“港版FDA”药物在港注册流程对比
在现行医药监管制度(无港版FDA)下,新药赴港上市需经历的流程为:获得“申请指南”)中所列地区的药证(每一个药证需时8-10个月,即为“第一层审查”);所需药证齐全后,则经香港卫生署进行第二层审查。前后耗时至少2年。而在建议的港版FDA(本会参考美国 FDA 及欧盟EMA设置及审查程序)下,新药上市则只需8-10个月。这会在很大程度上提升药企从研发到上市的效率,降低成本。此外,港版FDA的成立亦将有助于加速海内外药企入港开展临床试验,助推香港加速成为国际临床试验中心,进一步推动香港生物经济产业的可持续发展。
监督与审查本地区生物医药相关临床试验与生产的安全性与有效性,提升数据受认可效用。
在本港设立独立的医药监管机构可以从顶层设计上明确具国际标准的注册与监管法规、准入标准、风险评估,以及保持全球透明的数据与信息共享,以此提升本港医药注册与临床试验的安全性与有效性。
作为独立的统筹机构,在全球性流行病或公共卫生紧急时,港版FDA将有助于提高应急响应和效率,以确保得以持续稳定地维护本港市民健康福祉。
以“2019年新型冠状病毒肺炎疫情”为例,香港业界曾就特区政府引入中国科兴生物公司开发的克尔来福(CoronaVac)疫苗事项而进行广泛的讨论。理由是该疫苗第三期测试数据未曾在国际医学期刊刊登,不符香港政府早前自行订立的标准。除此之外,在疫情期间,业界亦对海外疫苗紧急入港使用产生不同的声音。港版FDA的成立,在独立的审评标准与程序之下,有助于在必要时迅速评估和批准相关药品、疫苗等在本港的使用,提升应对公共卫生紧急事件的灵敏度。
2. 在香港建立第三所医学院,以培养本港发展生物经济产业所缺人才
香港现时共有两所医学院,包括香港大学和香港中文大学,并以临床诊断与治疗、医学博士为重点。考虑到本港产业现状,第三所医学院目标面向本港高校,如香港科技大学等。所涉课程将致力于培养:第一,临床研究专家/科学家,以服务拟议港版FDA的人才需求,以及本港各类生物经济相关审评审查;第二,生物经济产业複合型人才,打通生物经济产业上中下游产业链,提升科学成果转化水平。
本会建议第三所医学院课程可包括:
1)4年制MBBS本科课程:课程将融合医学研究与临床实习,并提供为医生科学家量身定制的培训模组,以培养医学研究与临床试验方面的新兴人才。
2)7年制MBBS/PhD联合课程:通过将MBBS学位的课程与博士研究课程无缝接合,该计划专为成绩彪炳的医科生而设,使下一代医学领导者能够超越传统实践的局限性。
3)同时,该医学院将与医院管理局辖下的教学医院联接,以满足临床实践要求和促进医学研究,使毕业生能利用他们的医学专业知识来构思和执行科研转化,弥合实验室发现与实际临床应用之间的差距。
从长远来看,该医学院将寻求与拟议的 港版FDA 建立合作伙伴关係,确保医学院开发的诊断、治疗和医疗仪器能有良好的临床实践认证。
第四、总结
发展生物经济产业被全球主流国家或发达经济体证实为一项有巨大潜力的国家/地区战略举措,通过政府长达几十年的努力,生物经济产业在香港已初具规格。秉承致力于为香港建立一个创新及国际性的生物医药科技产业平台之宗旨,本会期待通过产学研官体系相关持份者的共同努力,在香港构建可持续发展的生物经济体系,建议举措包括:1. 以政府为主导:制定阶段性行之有效的发展规划;优化现行政策,尤其是现行资助政策;2. 基础设施领域的完善,包括但不限于:设立港版FDA,建立第三所医学院。
本会期待这些举措将有助于香港巧借政策东风与国际优势,改善当下发展生物经济产业的盲点,助力香港构建出可持续发展的生物经济体系!
第五、工作人员
作者:香港生物医药创新协会
总干事廖丽芳
项目助理梁毅言
项目助理郑力宁
指导:香港生物医药创新协会
常务会董会 & 科学顾问

 产业资讯
产业资讯
 医药财经
医药财经  2025-08-13
2025-08-13
 26
26

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-08-13
2025-08-13
 25
25

 产业资讯
产业资讯
 一度医药
一度医药  2025-08-13
2025-08-13
 27
27