 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻  2023-11-28
2023-11-28
 2616
2616
11月17日,2023年国家医保谈判在位于北京市顺义区的中华全国总工会国际交流中心拉开序幕。据新华社和央视新闻消息,本次谈判共有25名专家分为5组进行谈判工作,谈判时间预计持续4天,最终结果有望于12月左右公布。在经过申报、评审、测算后,共168个药品进入谈判竞价环节,为历年来品种最多的一次,涉及肿瘤、罕见病、慢性病等领域。
我国从2016年到2022年共经历七轮国家医保谈判;随着近年创新产品上市加速,国家医保谈判也步入常态化,谈判数量有所上升,谈判成功率逐渐提高,药品从上市到纳入医保的时间继续缩短,医保谈判并不简单追求谈判绝对降幅,兼顾药物临床疗效和经济性,部分价值不高的药品被替代,实现了医保基金的“腾笼换鸟”。
2016-2022年国家医保药品谈判情况
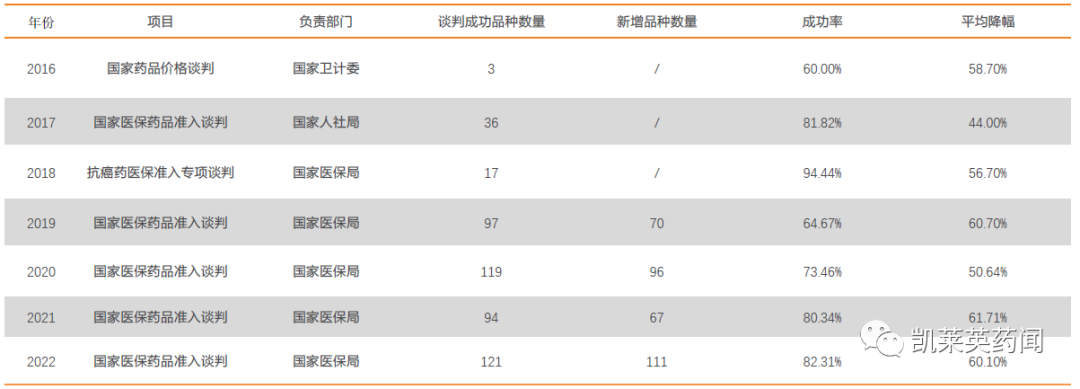
以抗肿瘤药物为例,2018-2022年我国共准入71种抗肿瘤药物,涉及24个瘤种,有效缓解部分患者无药可用的困境,特别是对于发病率较高的癌种如肺癌、乳腺癌等,国家医保局重点关注,准入了较多数量的药品。例如在肺癌治疗领域,近五年通过谈判共准入15个肺癌相关治疗产品,涵盖EGFR、ALK、MET等多个治疗靶点,大大丰富了临床用药选择。
医保目录重点肿瘤药品种
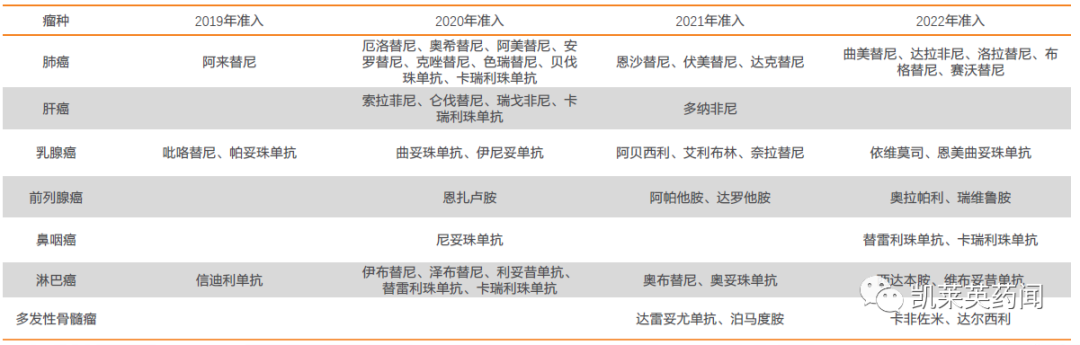
结合相关资料,我们对肺癌领域有潜力进入纳入医保目录的相关药物进行总结;其中涵盖6款尚未纳入医保的药物,以及3款目录内新增适应症参与医保谈判的产品。
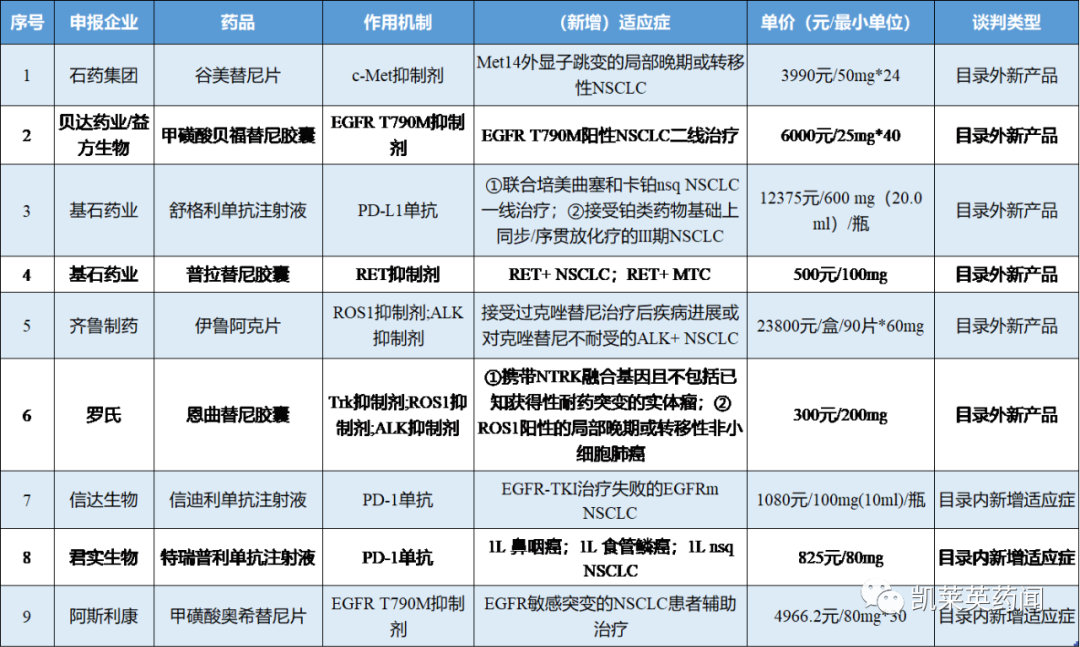
一
石药集团:谷美替尼片
谷美替尼是一种c-Met抑制剂,由中国科学院上海药物研究所与上海海和药物合作研发,2022年3月获国家药品监督管理局(NMPA)附条件批准上市,用于具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌的治疗。该药物能够选择性抑制c-Met激酶活性,进而抑制肿瘤细胞的增殖、迁移和侵袭。其上市申请主要是基于关键II期临床研究SCC244-108(GLORY研究)的有效性和安全性数据,对于具有METex14跳变的初治和经治局部晚期或转移性非小细胞肺癌患者的12个月随访数据显示:总体客观缓解率(ORR)为65.8%,其中初治患者ORR为70.5%,经治患者ORR为60%;中位无进展生存期(mPFS)为8.5个月;中位总生存期(mOS)为17.3个月,其中初治患者尚未达到,经治患者16.2个月,疗效明确。在安全性上,整体安全耐受。
二
贝达/益方:甲磺酸贝福替尼胶囊
贝福替尼是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),能够选择性地抑制EGFR T790M突变。2018年12月,贝达与益方生物达成合作,获得贝福替尼在中国大陆、香港和台湾地区的权益,并可独家在合作区域内进行该产品的开发及商业化。该产品是贝达药业第5款获批上市的创新药。2023年5月,NMPA批准甲磺酸贝福替尼胶囊上市,用于既往经EGFR-TKI治疗出现疾病进展,并且伴随EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。
该药物的获批是基于IBIO-102研究II期临床试验数据,研究结果已于2022年7月10日发表在国际著名肿瘤学期刊《胸部肿瘤学杂志》上,影响因子20.121。在一项单臂、多中心II期临床试验中,评估贝福替尼在既往一代/二代EGFR-TKI耐药后产生T790M突变的局部晚期或转移性NSCLC患者中疗效和安全性。结果显示:在ITT人群中,贝福替尼组经IRC评估的ORR为67.6%,DCR为94.8%,中位PFS为16.6个月,中位DOR为18.0个月。研究者评估的中位PFS为12.5个月。34例基线存在颅内靶病灶患者IRC评估的iORR为55.9%,颅内中位PFS目前尚未达到。安全性方面,绝大部分患者可耐受贝福替尼治疗,大多数不良反应为1级或2级,最常见的治疗相关不良事件是血小板减少、贫血、白细胞计数降低、头痛和皮疹等。
三
基石药业:舒格利单抗注射液、普拉替尼胶囊
1、舒格利单抗注射液
舒格利单抗属于抗PD-L1单抗,是一种最接近人体的天然G型免疫球蛋白4(IgG4)单抗药物,在患者体内产生免疫原性及相关毒性的风险更低。2023年10月,该药物第3 个适应症获NMPA附条件批准,单药用于治疗复发或难治性结外NK/T 细胞淋巴瘤(R/R ENKTL)成人患者。此前,该药物已在国内获批两项适应症:联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌患者的一线治疗,以及联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌患者的一线治疗(2021/12);用于同步或序贯放化疗后未发生疾病进展的不可切除的III期NSCLC患者巩固治疗(2022/05)。
此次获批是基于GEMSTONE-201 研究的结果,该研究旨在评估舒格利单抗作为单药治疗成人R/R ENKTL 患者的有效性和安全性。结果显示:(1)共80例难治复发患者入组并接受舒格利单抗治疗,中位随访18.7个月,IRRC评估的ORR为44.9%,CR率高达35.9%。(2)达到客观缓解的患者可以维持较长时间的疗效,中位缓解持续时间(DOR)未达到,6、12和18个月DOR率分别为91.3%、82.5%和82.5%。(3)中位总生存期(OS)未达到,6、12和18个月总生存率分别为79.2%、67.5%和57.9%。(4)IRRC与研究者评估的ORR之间的一致率为95.7%,且预先设定的亚组内也一致。(5)此外,有8例R/R ENKTL患者仍在长期完全缓解(CCR)中,其中1例舒格利单抗单药治疗的最长疗程为77个,已经持续CR达54.4个月;最短时间接受20多个疗程,已维持CR至少25个月。
在整个治疗过程中,80例患者中77例(96.3%)至少发生一起轻度不良事件,治疗相关严重不良事件(SAE)和免疫相关不良事件(irAE)的发生率非常低,19例(23.8%)患者报告了SAE,6例(7.5%)与治疗相关。25例(31.3%)患者发生特别关注的不良事件,2例(2.5%)≥3级。11例 (13.8%)患者因治疗中出现的不良事件而停用研究药物,5例(6.3%)与治疗相关,包括2例(2.5%)患者的血胆红素升高以及眼眶蜂窝织炎、发热和面神经疾病各1例(1.3%),均为1级或2级。
2、普拉替尼胶囊
普拉替尼是一种强效、选择性RET抑制剂,可选择性抑制RET 激酶活性,可剂量依赖性抑制RET及其下游分子磷酸化,有效抑制表达RET(野生型和多种突变型)的细胞增殖。该药物最早于2021年3 月获NMPA 批准上市,先后获批的适应症包括2L+ NSCLC、RET 突变MTC 和RET融合TC 以及1L RET 融合NSCLC。
在一项旨在评估普拉替尼在RET融合阳性NSCLC、RET突变型甲状腺髓样癌和其他RET融合的晚期实体瘤患者中的安全性、耐受性和有效性的全球临床研究中显示,普拉替尼在经含铂化疗的RET融合阳性NSCLC中国患者中显示出了优越和持久的抗肿瘤活性,总体缓解率(ORR) 为56%,中位缓解持续时间(DOR)未达到,6个月的DOR率为83%,安全性及耐受性良好,未出现与普拉替尼相关的不良事件导致的治疗终止或死亡。
此外,在 RET融合患者开展的I/II 期ARROW研究中,结果显示,
既往接受过铂类化疗的患者(基线有可测量病灶n=33),确认的ORR为66.7%,包括1例完全缓解和21例部分缓解;DCR为93.9%;
未接受过系统性治疗的患者(基线有可测量病灶n=30下),确认的ORR为83.3%,包括2例完全缓解和23例部分缓解;DCR为86.7%;
长期生存获益明显,中位总生存期均尚未达到。
四
齐鲁制药:伊鲁阿克片
伊鲁阿克是由齐鲁制药自主研发的新型ALK/ROS1抑制剂,可抑制不同融合类型的野生型以及ALK抑制剂耐药突变的ALK激酶活性,同时可有效抑制不同融合类型ROS1激酶的活性。公司曾对5个结构系列进行了多轮结构优化,根据构效关系筛选出抗肿瘤活性更强、不良反应发生率更低的新型螺环结构化合物。临床前研究数据显示,伊鲁阿克对不同融合类型及耐药突变的ALK和ROS1阳性的肿瘤细胞均具有显著的增殖抑制作用,在动物实验中也显示出优秀的抗肿瘤作用。
2023年6月,伊鲁阿克片获NMPA批准上市,,用于既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。根据在BMC Medicine发布的数据,伊鲁阿克治疗克唑替尼耐药的ALK阳性NSCLC患者的Ⅱ期INTELLECT研究中,显示伊鲁阿克客观缓解率(ORR)为69.9%,疾病控制率为96.6%,中位无进展生存期(mPFS)为19.8个月。总生存期(OS)正在进一步观察中,初步数据显示,1年OS率为85.2%,2年OS率为57.9%。在基线脑转移患者中,使用伊鲁阿克治疗的颅内缓解率为64%。
在安全性上,有93.2%的患者出现治疗相关任何级别不良反应,其中,3度及以上不良反应发生率为30.8%,分别有14.4%和11.0%的患者因治疗相关不良反应而导致治疗中断及剂量降低。最常见的导致剂量降低的原因为AST升高(2.7%)和皮疹(2.1%)。2.7%的患者因治疗相关不良反应导致永久性终止治疗。
五
罗氏:恩曲替尼胶囊
恩曲替尼是一种新型的具有中枢神经系统活性的口服酪氨酸激酶抑制剂(TKI),主要针对NTRK1/2/3、ROS1或ALK基因突变的肿瘤,是新一代广谱抗癌药,至少19种病理学肿瘤类型对恩曲替尼治疗有应答。恩曲替尼已被FDA授予突破性疗法(BTD);EMA 授予优先药品(PRIME);PMDA(日本卫生部)授予先驱药物(Sakigake)。2022年7月,该药物获NMPA批准用于NTRK融合阳性(不包括已知获得性耐药突变),患有局部晚期、转移性疾病或手术切除可能导致严重并发症,以及无满意替代治疗或既往治疗失败的成人和12岁及以上儿童实体瘤患者。
恩曲替尼获得NMPA批准用于治疗ROS1阳性NSCLC患者,主要基于3项临床研究(ALKA-372-001,STARTRK-1,STARTRK-2)的合并分析结果。2022年世界肺癌大会(WCLC 2022)数据更新表明,在ROS1阳性NSCLC患者的一线治疗中,恩曲替尼总体的客观缓解率(ORR)达68.7%,中位缓解持续时间(DOR)长达35.6个月。恩曲替尼显示出深度且持久的全身疗效,患者中位无进展生存期(PFS)达17.7个月,中位总生存时间(OS)为47.7个月。
此外,恩曲替尼展现了优秀的脑保护效果:经恩曲替尼治疗12个月的基线无脑转移患者颅内转移风险仅为1%;对于基线有可测量脑转移病灶的患者的颅内客观缓解率(IC-ORR)也达80.0%,表现出良好的透脑性及颅内抗肿瘤效果。由此可见,无论伴或不伴脑转移的患者,恩曲替尼均可带来长久且深远的生存获益。
六
信达生物:信迪利单抗注射液
信迪利单抗是信达生物和礼来共同合作研发的PD-1抑制剂药物。作为一种人类免疫球蛋白G4(IgG4)单克隆抗体,信迪利单抗能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的 PD-1/ PD-L1通路,重新激活淋巴细胞的抗肿瘤活性,从而达到治疗肿瘤的目的。2021年12月,达伯舒® (信迪利单抗注射液)成为唯一一个拥有包含一线非鳞状非小细胞肺癌、一线鳞状非小细胞肺癌、一线肝癌及霍奇金淋巴瘤在内的四项适应症获批,并均被纳入国家医保的PD-1抑制剂。2022年6月,达伯舒®第五项适应症一线食管鳞癌、第六项适应症一线胃及胃食管交界处腺癌在中国获批,达伯舒®成为唯一在五大高发瘤种一线治疗均获批的PD-1抑制剂。2023年1月,达伯舒®新增胃癌和食管癌两项适应症纳入国家医保目录,达伯舒®成为唯一纳入国家医保目录的胃癌PD-1抑制剂,也是唯一将五大高发瘤种一线治疗均纳入国家医保目录的PD-1抑制剂。本次谈判拟申请增加EGFR-TKI治疗失败的EGFRm NSCLC适应症。
七
君实生物:特瑞普利单抗注射液
特瑞普利单抗是我国批准上市的首个国产以PD-1为靶点的单抗药物,至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。截至目前,特瑞普利单抗已在中国获批6项适应症,目前2L黑色素瘤、3L鼻咽癌、2L尿路上皮癌。已纳入医保目录。
本次特瑞普利单抗将对三项一线适应症再次发起冲击,即鼻咽癌、食管鳞癌、nsq肺癌一线治疗。
八
阿斯利康:甲磺酸奥希替尼片
奥希替尼作为第三代EGFR-TKI,可以抑制EGFR敏感突变和EGFR T790M耐药突变,并具有抗中枢神经系统转移的临床活性。2019年8月,该药物获NMPA批准用于 EGFR突变阳性 NSCLC的一线治疗。在一项比较奥希替尼与标准一线治疗对具有EGFR突变的晚期或转移性非小细胞肺癌初治患者的疗效的3期FLAURA研究中,相比标准治疗(10.2个月),奥希替尼显著提高无进展生存期近一倍(18.9个月)。其中,亚洲亚组分析显示,奥希替尼组的中位无进展生存期为16.5个月,高于标准治疗组的11个月;奥希替尼组的中位缓解时间是17.6个月,是标准治疗组(8.7个月)的两倍;奥希替尼组的ORR为80%,而标准治疗组是75%。中位总生存期还未达到。使用奥希替尼的3级及以上毒性的发生率(40%)低于标准治疗组(48%)。本次,奥希替尼将携辅助治疗适应症入局谈判,推动适应症的持续拓展。
参考资料
中信证券、天风证券、渤海证券

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 99
99

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 89
89

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 79
79