 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2024-01-04
2024-01-04
 4058
4058
引言
ADC目前已成为治疗血液恶性肿瘤和实体瘤的一类热门药物,进行了广泛的临床前和临床研究。然而,与大多数细胞毒性药物的情况一样,由于耐药机制的出现,ADC作为单一疗法产生的客观反应或临床获益的持续时间仍然有限。因此,ADC与其他抗癌药物的组合成为ADC药物开发的一个重要方向。
2023年9月,胡朝红博士受邀在BiG ADC专题研讨会上作主题报告:【ADC和 PD-1 的联合疗法考量】深受听众好评,现分享以飨读者。

作者|胡朝红-乐普生物执行董事兼联席CEO
编辑|BiG媒体部
* 本文系BiG媒体部会后整理,可能存在疏漏,仅供行业参考交流,不构成任何投资及用药建议。
01 国内外ADC与IO联合用药的整体概况
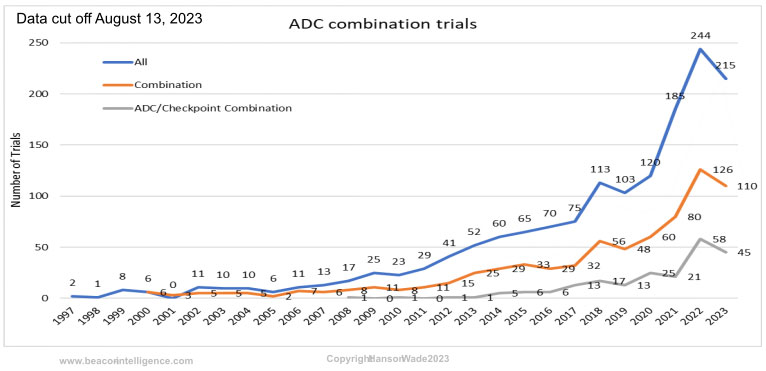
根据Hanson Wade数据库(截止到2023年8月13日)显示:1997年到2007年的十年之间,全球每年启动的ADC临床研究增长缓慢,,而到2017年,ADC临床研究启动则增加到75项,在后续的5-6年里,ADC临床研究启动数量迅速增加,2022年更是达到244项。
值得关注的是:在这244项启动的ADC临床研究里有超过一半都是联合用药,占到126项,而这其中ADC与IO的联合用药达到58项,占到了ADC联合用药的大约一半。
ADC在中国NMPA注册申请及联合用药是什么情况呢?
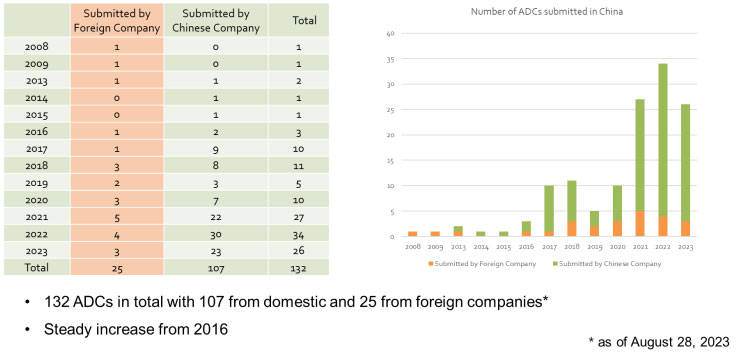
基于美雅珂生物对NMPA网站ADC申报临床的追踪,2008年到2023年,大概有132个ADC分子申报了IND。其中,国外公司申报了25项,中国公司申报了107项。从以下图表可见,从2016年以后,ADC申报有非常迅猛的增长。
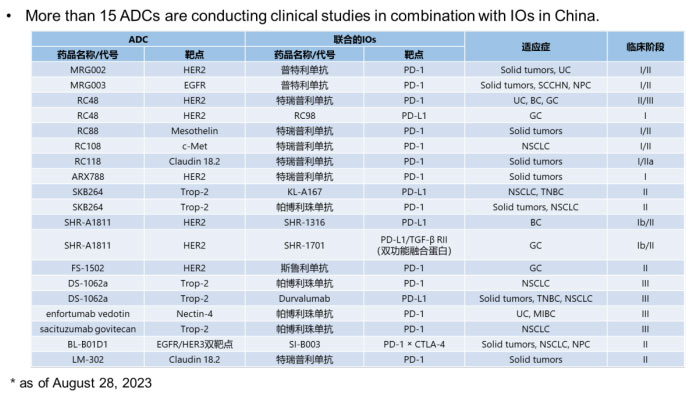
截止到2023年8月,从申报和临床试验登记情况来看,超过15款ADC分子正在中国开展IO联合用药,包括乐普生物及其全资子公司美雅珂MRG002/MRG003联合抗PD-1的普特利单抗、荣昌生物的维迪西妥单抗(RC48)联合抗PD-1的特瑞普利单抗、吉利德科学(Gilead Sciences)的Trodelvy(sacituzumab govitecan)联合抗PD-1的帕博利珠单抗等等,阿斯利康最近也计划在国内开展联合用药。所以后续国内会看到更多的联合用药案例。
02 为什么要进行联合用药?
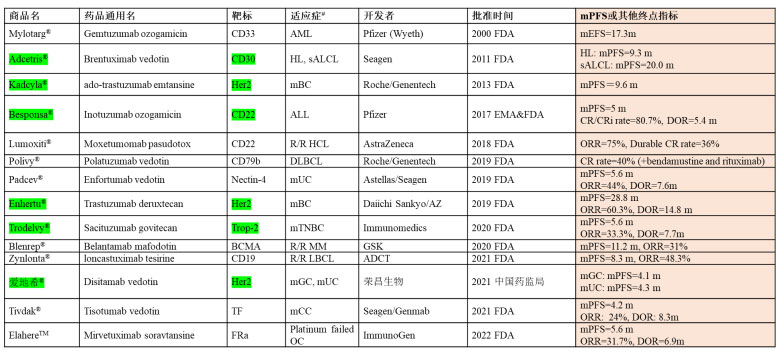
从全球获批的10余款ADC来看(光免疫疗法Akalux暂不在本次讨论范围),除了Polivy是通过联合苯达莫司汀和利妥昔单抗(美罗华),获批用于治疗既往已接受至少2种疗法的R/R DLBCL患者,其余的ADC都是基于单药/单臂在末线病人上的临床研究结果获得加速上市批准的,所以从适应症拓展以及怎样让更多的病人在前线获益是一个值得深度思考的问题。加之,这其中有6款药物的中位mPFS只有4到6个月,因此ADC疗效仍需要有很大的提升。
从肿瘤生物学来看,第一,肿瘤具有非常高度的异质性,同一种肿瘤,在不同病人身上没有一模一样的。第二,同一个病人的肿瘤,原发病灶和转移病灶不一样,比如说脑转移、肝转移病灶的肿瘤也不一样。第三,即使是同一个肿瘤块也有多种基因型和表型。所以从这些层面看,肿瘤的高度异质性要求我们对肿瘤生物学有更深入的理解和思考。
从用药角度来看,同一款药物,对于有的病人可能导致肿瘤消失,对有的病人可能是不可耐受,甚至可能是致死性的。不同年龄、不同性别、不同营养状况、不同基础病、不同前期用药都可能影响到药物的药代动力学。在临床研究中,既使是同一个病人也会出现有的靶病灶消失,有的病灶持续增长的情况。所以为什么在临床中有的病人很快达到CR但是后续很快就复发而PD,这也需要引起深度的思考。
正是由于高度的肿瘤异质性,我们必须要从全方位不同的角度对肿瘤细胞进行攻击,对于ADC来讲,跟标准化疗的联合,跟抗血管生成药物的联合,跟单抗的联合、跟TKI的联合,还有目前热门的肿瘤免疫联合疗法。
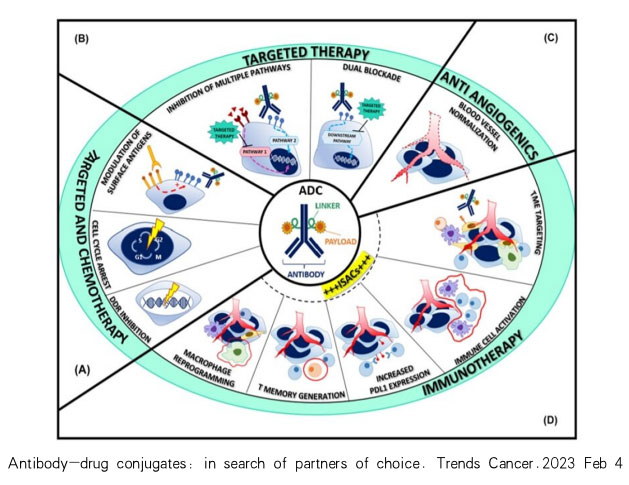
03 案例分享- MMAE-based ADCs与IO的联合
在全球已上市的10余款ADC分子中,其中五款使用了MMAE(单甲基澳瑞他汀E,Monomethyl auristatin E)作为有效载荷,而为什么MMAE类ADC和PD1/L1抑制剂是一个优选组合?
从作用机制上来看:MMAE类 ADC可以通过诱导免疫原性细胞死亡(ICD)来增强肿瘤免疫。
Seagen 在2020年公开的一些临床前研究结果显示,MMAE类ADC在破坏微管蛋白导致肿瘤细胞死亡的过程中会引发内质网应激 (ER stress)和免疫原性细胞死亡(immunogenic cell death,ICD),ICD导致免疫激活分子danger-associated molecular patterns (DAMPs) 释放,例如ATP, 、high-mobility group box 1 (HMGB1)、calreticulin (CRT)等,这些DAMPs 会激活 innate immunity 而引发抗肿瘤T细胞反应,这样就会有利于PD1/L1抑制剂的施用进一步增强T细胞反应,从而达到大大增强肿瘤细胞杀伤的效果。
除了作用机制上可行,是否有临床数据支持?
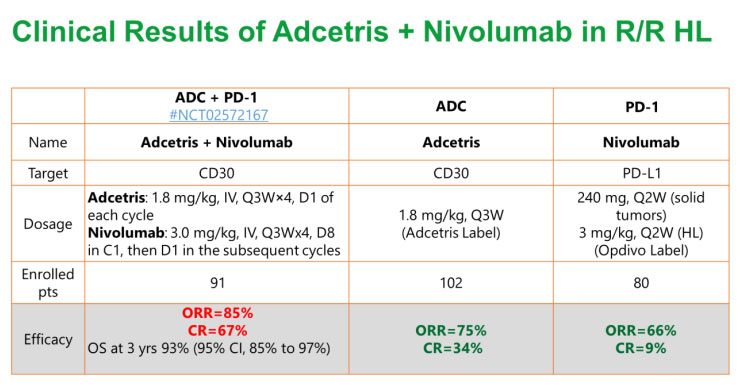
一个临床案例是在Adcetris(抗CD30 的MMAE类ADC)联合 PD-1抑制剂Opdivo(nivolumab,纳武利尤单抗)治疗复发或难治性霍奇金淋巴瘤 (HL) 患者的I/II期临床试验中(NCT02572167),Adcetris联合 Nivolumab展现了85%的ORR和67%的CR,几乎是关键II期试验中Adcetris单药治疗CR率的两倍。
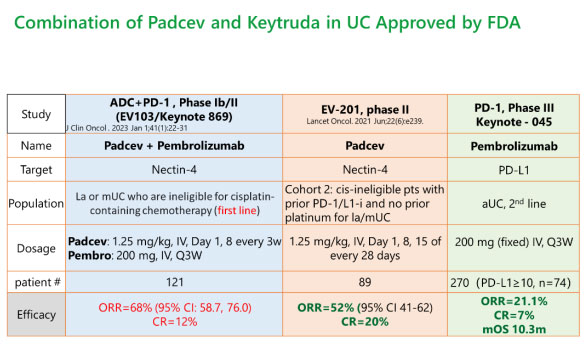
另一个临床案例是2023年4月,美国FDA根据EV-103试验的结果,加速批准了Padcev(Nectin-4 ADC)联合Keytruda治疗不适合接受含顺铂化疗的la/mUC成人患者。从下表数据可见,K药单独用药ORR仅为21%,在既往接受过PD1/L1治疗患者中使用Padcev的ORR是52%,但Padcev联合Keytruda在一线病人中的ORR达到68%。
此外,DS8201目前也在开展多项联合疗法,临床结果值得期待。
04 关于ADC联合用药的思考
科学机制上的探索
首先需要思考ADC为什么要进行联合用药?跟什么药物联合?如何选择合适的适应症人群?目前适应症已经越来越细分,如果你希望做的新药能够快速上市,最关键的是找到一个最合适的人群把阳性信号做出来,当然这基于对靶点生物学的理解,对适应症的理解。
ADC的主要作用机制很简单,靶向结合、内吞、释放毒素、杀伤肿瘤,但是真的这么简单吗?
Antigen binding的亲和力要多高?Payload除了本身的毒性作用,是否还有免疫调控机制?就像Dxd的获益时长可能有一些我们不知道的免疫机制存在。现在有非常大量的临床前研究和临床研究证实,ADC确实存在一些免疫调节机制,包括诱导免疫原性细胞死亡,刺激树突状细胞成熟,增加T细胞浸润,增强免疫记忆力,增加PD-L1的表达等等。抗肿瘤的ADC药物(包括单克隆抗体),准确靶向到肿瘤部位的药物量可能不到1%,其他的99%到哪里去了?仍需要很多机制上的探索。
旁观者效应(Bystander effect)
目前的研究通常是在体外细胞实验中观察到payload释放和旁观者效应,但是在临床研究中我们是否有证据来证明Bystander effect具有实质性的临床意义,ADC在体内肿瘤中是否真的释放了毒素?释放了多少毒素?有多少又递送到癌旁细胞和组织?我们并不知道。关于旁观者效应仍需要临床证据来证实其确实有临床意义。
毒性问题
Toxicity overlap,尤其是剂量限制性毒性(DLT)的重叠性。如果ADC单药和未来联合用药分子具有相同或者相似的毒性,特别是DLT,那么将来的临床试验将会非常地担忧,所以制定联合用药风险管理计划十分重要。
此外,还有一些不可预期的事件。例如2023年7月,ADC Therapeutics终止了Zynlonta(已上市的CD19 ADC)联合利妥昔单抗治疗既往未经治疗的DLBCL患者的Ⅱ期临床试验,原因是入组患者中出现了7例因极端呼吸事件死亡和5例3级或4级事件。已上市的CD19 ADC联合非常成熟的CD20单抗,没有人能预见到会出现严重的呼吸系统极端反应并导致病人死亡,所以一定要心存敬畏,不要盲目去做,临床开发过程中尽量小心爬坡,特别关注毒性反应。
如果安全性没有问题,接下来要摸索一个最佳给药方案。包括每种药物组合的最佳剂量、给药频率、给药顺序(序贯/同时)等。
总的来说
截止目前,联合治疗在ADC上取得的成功还是非常有限的,后续还需要大家一起努力,心存敬畏,不断探索,希望为病患者带来更多更好的安全有效疗法。
参考文献
[1] Hanson Wade 2023. www.beacon-intelligence.com
[2] 美雅珂公司信息追踪
[3] Annals of Oncology, Volume 29, p13-16, Issue 1, 2018
[4] Seagen. For Investor and Analyst Nov 2020
[5]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-enfortumab-vedotin-ejfv-pembrolizumab-locally-advanced-or-metastatic
[6] Antibody-drug conjugates: in search of partners of choice. Trends Cancer.2023 Feb 4
[7] Jefferis R. Antibody therapeutics: isotype and glycoform selection. Expert Opin Biol Ther. 2007 Sep;7(9):1401-13. doi: 10.1517/14712598.7.9.1401. PMID: 17727329

 产业资讯
产业资讯
 一度医药
一度医药  2025-07-18
2025-07-18
 35
35

 产业资讯
产业资讯
 药渡Daily
药渡Daily  2025-07-18
2025-07-18
 37
37

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-07-18
2025-07-18
 35
35