 产业资讯
产业资讯
 识林
识林  2024-07-26
2024-07-26
 1279
1279
美国 FDA 于 7 月 17 日发布了《2023 财年厂房设施检查年报》,为我们了解 FDA 的检查情况提供了一个全景图。
从报告中,我们可以了解到,2023 财年,在 FDA 注册的中国药品(包括原料药)和医疗器械设施有 6,897 家,FDA 对这些中国设施进行了 53 次 GMP 检查,74 次批准前/许可前检查,41 次监督检查,12 次有因检查。
相比之下,在 FDA 注册的印度设施有 1,245 家,FDA 对这些印度设施进行了 155 次 GMP 检查,113 次批准前/许可前检查,110 次监督检查,45 次有因检查。
根据 FDA 6 月份发布的另一份年报 —《2023 财年药品质量状况报告》,FDA 对于印度检查覆盖率较高,而中国检查覆盖率较低的解释是由于旅行限制导致检查延迟。
首先来介绍一下 FDA 发布这份厂房设施检查年报的背景。根据 2012年《FDA 安全与创新法》(FDASIA)要求 FDA 每年在网站上公布依据《联邦食品、药品和化妆品法》(FDCA)第 510 条注册的厂房设施的检查报告。此后,《21 世纪医药法》和 2017 年《FDA 重授权法》(FDARA)对这一要求进行了小幅修订。2022 年 12 月的《食品药品综合改革法》(FDORA)对报告要求进行了大幅修订。
根据修订后的法律要求,FDA 应不迟于每年的 5 月 1 日在其网站上发布厂房设施检查年报,内容应包括:
上一财年根据 FDCA 第 510 条注册的美国本土和海外的厂房设施数量
各关注地区此类注册设施的数量;
上一财年度检查的本土设施数量和海外设施数量,包括各关注地区设施数量;
上一财年度执行的检查次数;
上一财年度执行的例行监督检查次数,包括各关注地区;
上一财年度执行的有因检查次数,包括每各关注地区;
达成的协议认可或其它方式认可的检查次数,包括各关注地区;
原料药(API)或成品制剂(FDF)每类厂房设施的数量;
FDA 预算中用于上述检查的百分比;
FDA 扩大对外国监管机构认可的检查的情况,包括扩大此类认可范围方面存在的障碍。
这里的关注地区(Region of Interest)法律定义是指包括中国、印度、欧盟、英国以及 FDA 认为有必要对该地区进行特定检查的外国国家或地理区域。
下面我们具体来看看一些数据:
表1 美国本土和海外药品和器械注册厂房设施数量
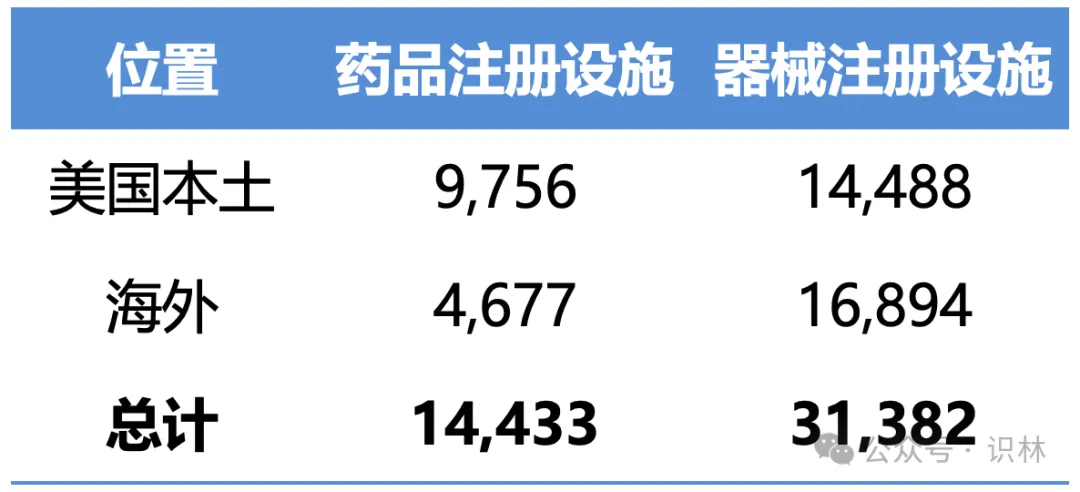
表2 关注地区注册厂房设施数量(编者注:这里的厂房设施包括药品和器械设施)

表3 注册药品设施类型
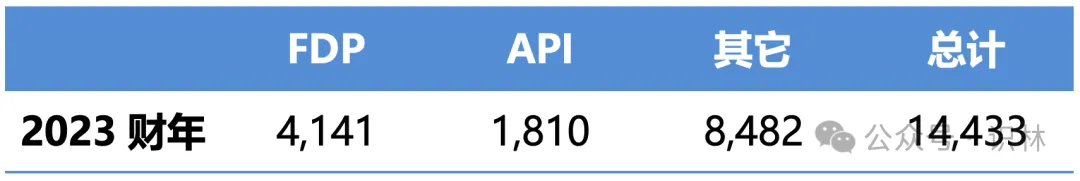
表4 美国本土和海外设施检查数量(GMP检查)

表5 支持申请行动的厂房设施检查数量(批准前/许可前检查)

表6 例行监督检查和有因检查数量
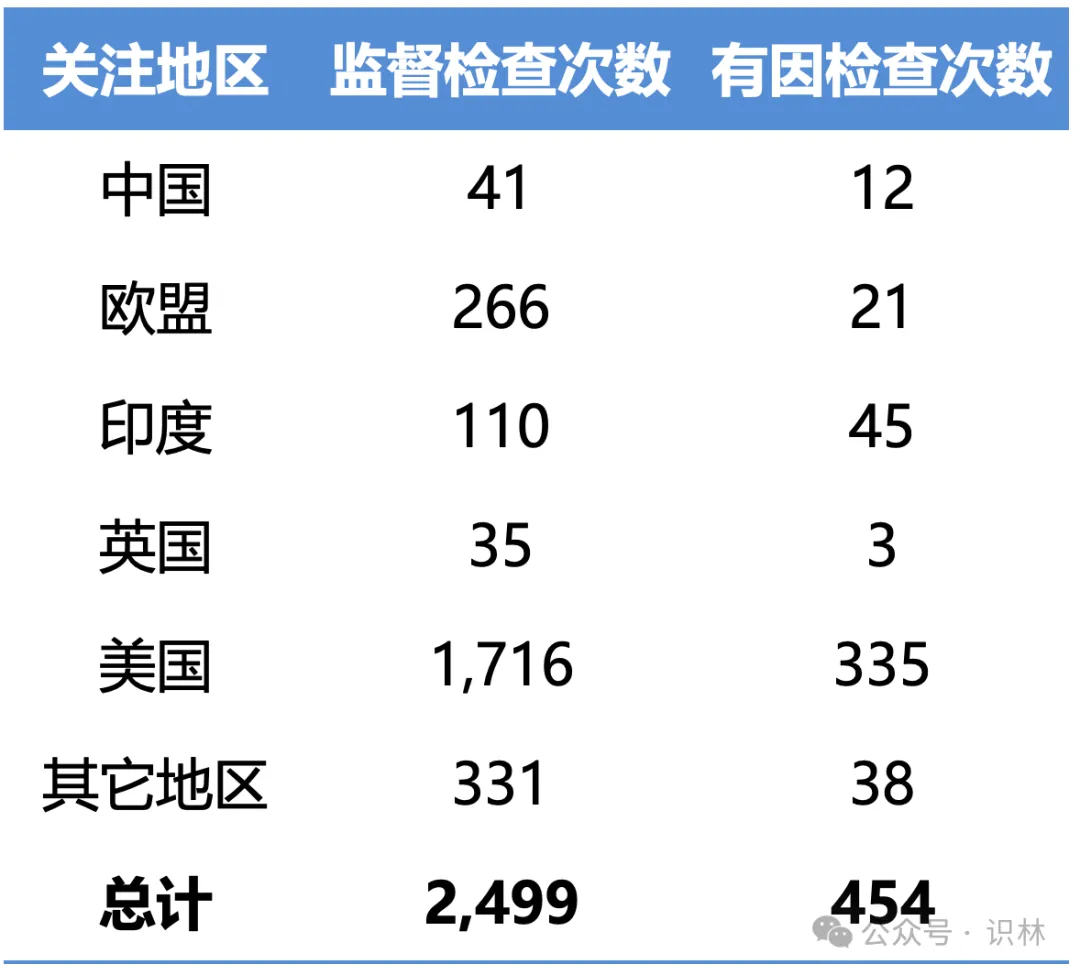
表7 通过互认协议(Mutual Recognition Agreement,MRA)由外国监管机构执行的例行监督检查和有因检查数量

FDA 在报告中表示扩大了与欧盟的互认协议范围,以包括兽药,并与瑞士签署并生效了互认协议。此外,FDA 最近实施了第三国检查,以扩大 MRA 影响范围。

 产业资讯
产业资讯
 药明康德
药明康德  2025-12-19
2025-12-19
 11
11
 产业资讯
产业资讯
 药智网
药智网  2025-12-19
2025-12-19
 11
11

 产业资讯
产业资讯
 高特佳投资
高特佳投资  2025-12-19
2025-12-19
 18
18