 产业资讯
产业资讯
 猎药人俱乐部
猎药人俱乐部  2024-12-25
2024-12-25
 783
783
2024年截至目前,FDA已经批准了130个项目,包括已获批药物的新适应症拓展,如默沙东的重磅药物抗PD1疗法Keytruda。其中在40多个获批的新药项目中,有5家企业在今年首度有产品获批上市,分别是:Madrigal Pharmaceuticals的Rezdiffra(第一款用于治疗MASH 的药物)、X4 Pharmaceuticals的Xolremdi(第一款针对 WHIM 综合征的靶向治疗药物)、Day One Biopharmaceuticals的儿童低级别胶质瘤(pediatric low-grade glioma, PLGG)治疗药物Ojemda、ImmunityBio 的肌层浸润性膀胱癌(NMIBC)治疗药物Anktiva,以及Geron Corporation在成立34年后获批的第一款用于中低风险骨髓增生异常综合征患者的产品Rytelo。
本文将盘点在2024年首次迎来新药获批的这5家企业。
01
Madrigal Pharmaceuticals——Rezdiffra

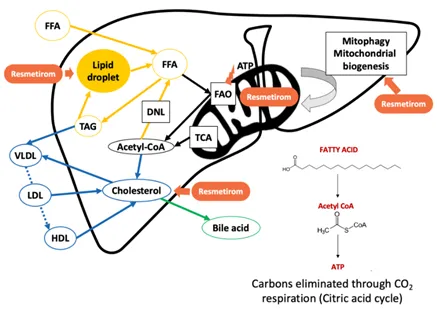
Rezdiffra是今年期待值最高的药物之一,2024年3月15日,Resmetirom(商品名:Rezdiffra)成为首款获FDA批准上市的治疗代谢功能障碍相关脂肪性肝炎(MASH)的新药,在搭配合理饮食与运动的情况下,Rezdiffra特别适用于中度至晚期肝纤维化患者。
MASH是由过量脂肪细胞引起的肝脏炎症,可导致进行性肝纤维化和肝硬化。MASH的患者基数相当庞大,存在巨大的未被满足的临床治疗需求。根据流行病学数据,全球MASH患病人数从2016年的3.1亿上升到2020年的3.5亿,并预计到2030年将达到4.9亿。在美国,该疾病占所有肝细胞癌病例的18%。
Rezdiffra 靶向甲状腺激素受体β(THR-β),有助于维持肝脏稳态。FDA的批准基于 MAESTRO-NASH III 期试验的结果,在该试验中,Rezdiffra 达到了两个主要终点,显著改善了疾病进展和肝纤维化。服用80mg Rezdiffra的患者中有25.9%实现MASH消除,服用100mg的患者中有29.9% 没有纤维化恶化。
02
X4 Pharmaceuticals——Xolremdi

今年4月,在公司裁员20%以及次停止肿瘤项目以节省的情况下,X4 Pharmaceuticals第一个WHIM
综合征靶向治疗药物获批上市,Xolremdi是X4的首个获批产品。
根据 NIH 的数据,美国只有不到 1,000 人被诊断出患有 WHIM,WHIM综合征是一种先天性免疫缺陷病,即表现为疣(warts)、低丙种球蛋白血症(hypogammaglobulinema)、感染(infection)以及无效生成性慢性粒细胞缺乏(myelokathexis)的四联症。低丙种球蛋白血症是一种由低抗体水平引起的疾病,而无效生成性慢性粒细胞缺乏是一种先天性白细胞疾病。
Xolremdi 是一种口服 CXCR4 拮抗剂,旨在将中性粒细胞、淋巴细胞和单核细胞等白细胞从骨髓动员到血液中,以改善免疫缺陷。2023 年 5 月,X4 公布了 III 期 4WHIM 试验的积极结果,与安慰剂相比,年化感染率降低了60%;接受治疗的受试者每年感染少于 1 次,而安慰剂组为 4.5 次。
03
Day One Biopharmaceuticals——Ojemda

同年4月,Day One Biopharmaceuticals 首个药物获得了
FDA批准——Tovorafenib(商品名:Ojemda),治疗6个月及以上的儿童低级别胶质瘤(PLGG)患者,特别是那些肿瘤携带BRAF融合/重排或BRAF
V600突变的患者,并且是FDA首次针对携带BRAF重排的儿童PLGG患者的系统治疗批准。获批后,Day One
收到了罕见儿科疾病优先审评券(PRVs)。
根据疾控中心的数据,每年美国约有 15,000 名儿童和青少年被诊断出患有癌症。然而,据《纽约时报》报道,联邦癌症研究资金中只有 4% 用于儿科肿瘤学。Day One 的成立是“为了弥补儿科和成人癌症患者在治疗选择方面的差距”。
Tovorafenib加速批准是基于Tovorafenib在II期FIREFLY-1研究中的表现。Tovorafenib根据患者的体表面积每周给药一次,剂量范围从290-476mg/m2,最大剂量为600mg。研究结果显示,ORR为51%,中位持续缓解时间(DoR)为13.8个月。
04
Geron Corporation——Rytelo

Geron
Corporation今年则证明了坚持是有回报的,6月份,该公司在成立34年后,首次有产品获批上市,Rytelo用于治疗患有低风险至中等-1风险的骨髓增生异常综合征(MDS)成年患者,这些患者患有输血依赖性贫血,需要8周内输入4个或更多的红细胞单位,且患者对红细胞生成刺激剂(ESAs)无应答或产生耐药,或不适合使用ESAs。
Rytelo是一种寡核苷酸,专门靶向并结合端粒酶的RNA模板,从而抑制其活性,通过阻断端粒酶,Rytelo防止恶性细胞中端粒的维持,导致它们逐渐缩短。这种酶在癌细胞增殖中起着至关重要的作用。
Rytelo是首个获美国FDA批准的端粒酶抑制剂。自1984年端粒酶被发现以来,经过近40年的等待,产业界终于迎来首款端粒酶靶向疗法。Rytelo被行业媒体Evaluate列为今年10大潜在重磅疗法之一。
FDA 对 Rytelo 的批准基于 III 期 IMerge 试验的积极结果,Rytelo 的红细胞输血独立性 (RBC-TI) 率至少连续24周高于安慰剂组——治疗组为 28%,安慰剂组为3%。在这些应答者中,RBC-TI 的中位持续时间为 1.5 年。
05
ImmunityBio——Anktiva

华裔医药界首富Patrick
Soon-Shiong的癌症生物技术公司ImmunityBio于今年4月获得了首个FDA批准——Anktiva联合卡介苗(BCG),用于治疗卡介苗不响应的非肌层浸润性膀胱癌
(NMIBC) 伴原位癌 (CIS),伴或不伴状瘤患者。这是全球首个获得监管批准的IL-15新药。
Anktiva是一种首创的IL-15激动剂,用于治疗非肌层浸润性膀胱癌(NMIBC)。其通过活化NK细胞,促进CD8+杀伤性T细胞的工作,来对抗肿瘤。与传统治疗相比,其具有更好的药代动力学特性及更持久的疗效,能够恢复肿瘤克隆抵抗的记忆T细胞活动,从而达到更长时间的应答。
卡介苗是一种结核病疫苗,在某些膀胱癌中也会在 BCG无反应的原位癌患者中引发免疫反应。在 II/III 期 QUILT-3.032 研究中,使用 Anktiva 和 BCG 维持治疗长达 18 个月,完全缓解率为 62%,在 2023 年 11 月的临界值时,缓解持续时间超过 47 个月。
业内对Anktiva的治疗前景和销售潜力一度十分看好。但是,根据ImmunityBio发布的2024年第二季度财报,Anktiva在第二季度的总销售仅为99万美元。根据公开资料查询,Anktiva的零售价约为36000美元每剂,预估Anktiva仅卖出去不到30剂。

 产业资讯
产业资讯
 米内网
米内网  2025-11-11
2025-11-11
 26
26

 产业资讯
产业资讯
 药智网
药智网  2025-11-11
2025-11-11
 24
24

 产业资讯
产业资讯
 医麦客
医麦客  2025-11-11
2025-11-11
 28
28