 产业资讯
产业资讯
 药融圈
药融圈  2025-01-01
2025-01-01
 929
929
从摩熵医药数据pharma.bcpmdata.com(原药融云数据)获悉,成立于1988年的Pharming Group是一家全球性的生物制药公司,总部位于荷兰莱顿,美国总部位于新泽西州沃伦,公司正在商业化和开发一系列创新的蛋白质替代疗法和精准药物,致力于改变罕见病、衰弱性疾病和危及生命的疾病患者的生活。

Sijmen de Vries博士
公司执行董事兼首席执行官Sijmen de Vries博士在2008年加入公司,并一直担任CEO至今,加入Pharming之前,de Vries博士是4-Antibody和Morphochem AG的首席执行官,另外他还曾在Novartis、Novartis Ophthalmics和SmithKline Beecham Pharmaceuticals plc担任过高级管理业务和商业管理职位。
已商业化产品近两年面临专利保护到期
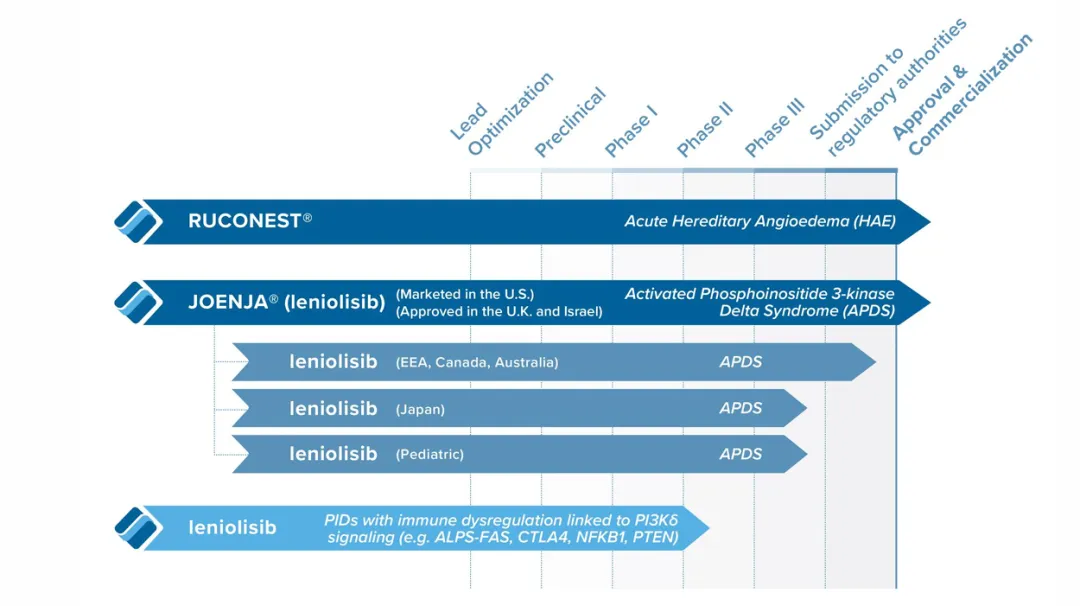
Pharming的首个商业化产品RUCONEST(conestat alfa)是首个也是唯一一个重组人C1酯酶抑制剂(rhC1INH)蛋白替代疗法,于2014年7月17日被批准用于治疗成人和青少年遗传性血管性水肿(HAE)患者的急性发作。在美国、欧洲经济区和英国通过公司自己的销售和营销机构进行商业化,在世界其他地区则通过分销网络进行商业化,RUCONEST最大的市场是美国,占了2023年收入的97%。在美国和欧盟的专利保护期到2026年10月7日。
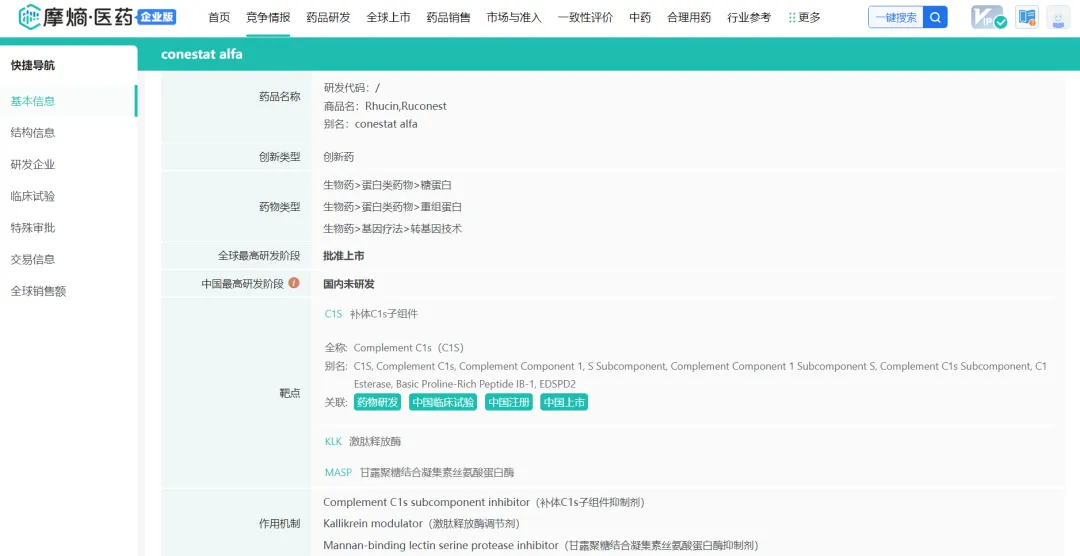
摩熵医药数据pharma.bcpmdata.com(原药融云数据):药品研发信息
HAE是以发作性、自限性、局限性皮肤和黏膜非凹陷性水肿为特征的原发性补体缺陷病,最常见的病因是一种名为人C1抑制剂(C1INH)的血浆蛋白功能缺乏,患者缺乏C1INH会导致补体级联反应失控,造成某些介质过度分泌,导致液体从血管渗漏到组织间隙。HAE发作时最常见的症状是激肽释放酶(kallikrein)分泌过多,从而导致液体过度渗漏到组织间隙(水肿或肿胀),患者可能会出现阵发性剧烈腹痛、恶心和呕吐,并因肠壁肿胀而加剧。气道或喉部肿胀尤其危险,可导致窒息死亡。如不及时治疗,发作可持续数天。
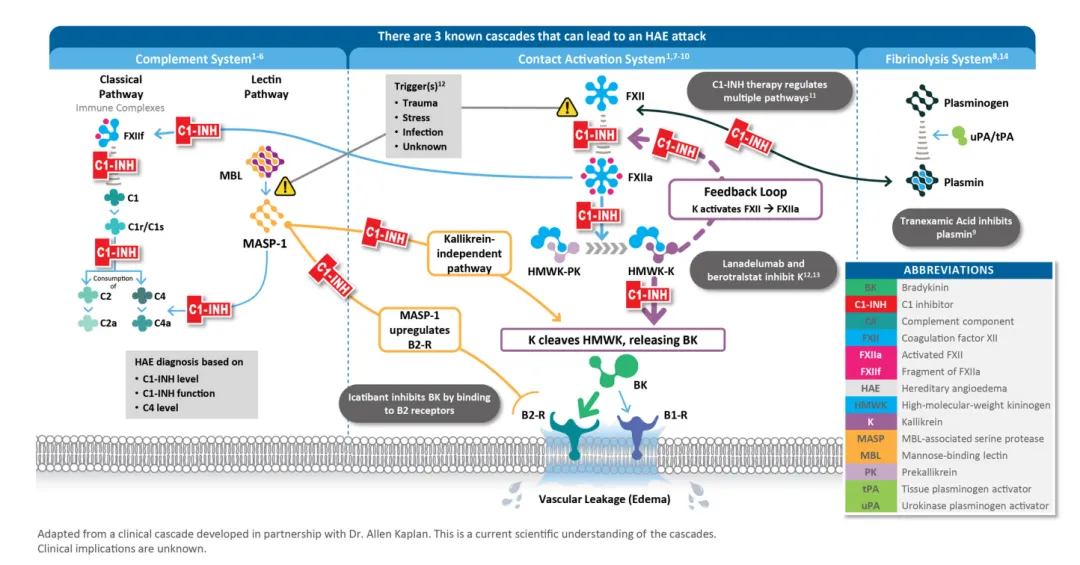
研究及事实证明,RUCONEST可使C1INH活性水平恢复正常,在治疗HAE攻击方面具有临床意义。RUCONEST与多种目标分子不可逆地结合,其中重要的包括凝血因子FXII和蛋白酶kallikrein,kallikrein(未结合时)可将血浆蛋白裂解为缓激肽和其他产物。通过与这些分子结合并使其化学失活,RUCONEST可阻止缓激肽和所有其他介质的产生,从而阻止HAE的发作。
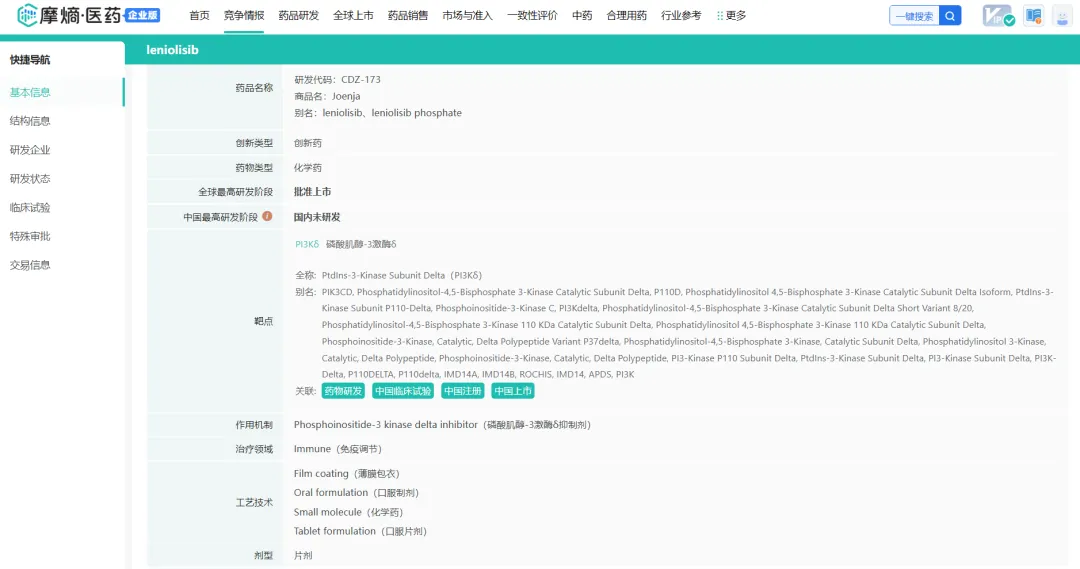
公司的第二个商业化产品Joenja(leniolisib)是首个也是唯一获批的活化磷脂酰肌醇3-激酶δ(PI3Kδ)综合征 (APDS)疾病调整疗法,这是一种小分子PI3Kδ抑制剂,2019年获得诺华公司的许可,2023年3月获得美国FDA批准,用于治疗12岁及以上成人和儿童APDS患者;2024年9月26日,英国MHRA授予了Joenja(leniolisib)的上市许可,也是用于治疗12岁及以上成人和儿童APDS患者。
图源网络
APDS是一种进行性原发性免疫缺陷和调节障碍疾病,其特征是严重、反复的鼻窦肺部感染;持续、严重或反复的疱疹病毒感染,尤其是Epstein-Barr病毒(EBV)和巨细胞病毒(CMV);淋巴结病、肝肿大、脾肿大和/或结节性淋巴增生;自身免疫性细胞减少症;肠病;支气管扩张;恶性肿瘤,尤其是淋巴瘤;以及B和T细胞功能失调。
“老药”扩展,新适应症研究
一、leniolisib针对APDS的扩展研究
Pharming还在开展监管和临床开发工作,以使leniolisib能用于治疗全球各年龄段的APDS患者,目前在两项针对儿童APDS患者的临床试验3期研究中进行评估,在日本进行一项针对12岁及以上成人和儿童APDS患者的临床试验3期研究。
1、在日本的研究
2023年5月,日本厚生劳动省授予leniolisib治疗APDS的“孤儿药认定”。2023年8月,在日本进行的一项临床试验3期研究招募了首位患者,这项单臂、开放标签临床试验评估leniolisib对3名确诊为APDS的12岁及以上患者的安全性、耐受性和疗效。每位患者按体重服用leniolisib,剂量最高为70毫克,每天两次,连续服用12周。Pharming计划在完成相应的临床试验后,向日本PMDA提交leniolisib的批准申请。根据ODD对申请的优先审查,预计将在九个月内做出批准决定,参加试验的合格患者将通过开放标签延长试验继续接受研究药物治疗至少一年。
2、针对1~11岁儿童APDS患者的研究
2022年上半年,Pharming收到了EMA和MHRA关于leniolisib治疗儿童APDS的儿科研究计划(PIP)的积极决定。leniolisib儿科研究计划包括两项计划中的全球临床试验,分别针对4~11岁和1~6岁的儿童APDS患者。这两项研究于2023年启动,将为全球范围内的儿科标签扩展监管申请提供支持。
摩熵医药数据pharma.bcpmdata.com(原药融云数据):药品研发信息
针对4~11岁患者的临床试验3期研究在美国、日本和欧洲的研究机构评估,这项单臂、开放标签临床试验评估leniolisib的安全性、耐受性和疗效,研究的主要疗效终点是在12周时指数淋巴结大小的减少和幼稚B细胞占总B细胞比例的增加。2024年4月,Pharming宣布该临床试验3期研究完成患者招募;2024年,公司宣布该临床试验取得积极顶线数据。计划从2025年开始,针对4~11岁患者的试验数据将纳入全球监管申报。
针对1~6岁患者的临床试验3期研究在美国、日本和欧盟的研究机构进行,这项单臂、开放标签、多国临床试验评估leniolisib对15名确诊为APDS的1~6岁儿童的安全性、耐受性和疗效,患者接受leniolisib特定的儿科颗粒制剂治疗。首例患者已于2023年11月服药,目前该研究的入组工作仍在按计划进行。
二、leniolisib的适应症扩展
争取leniolisib在更多地区获得监管部门批准并扩大儿科用药范围的同时,Pharming还在研究leniolisib有可能为患者带来价值的其他适应症,并将其列为优先治疗领域。PI3Kδ已被确定为多种疾病的重要致病因子,leniolisib通过降低PI3Kδ的活性,有助于重新平衡PID(原发性免疫缺陷)中的免疫失调,对包括淋巴细胞增殖和自身免疫在内的临床表现产生积极影响,leniolisib有可能成为一种有效且可耐受的慢性治疗方法,用于治疗与PI3Kδ信号相关的免疫失调性PID。
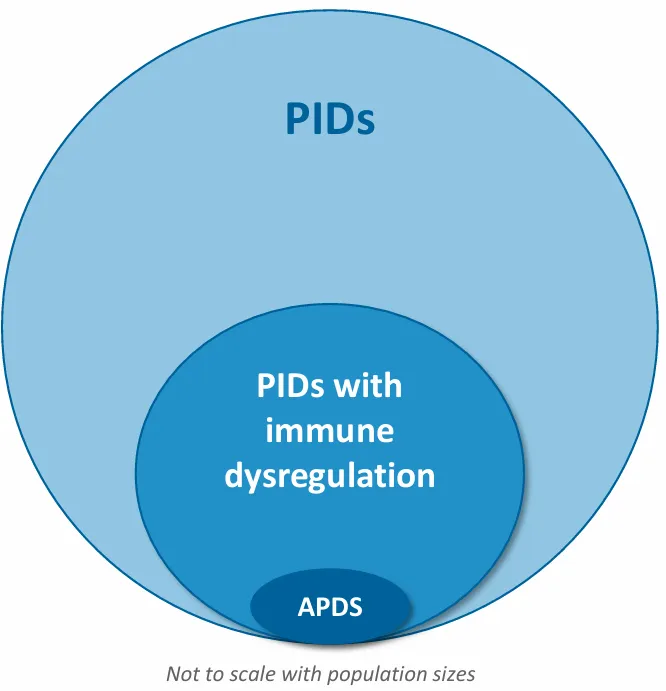
2023年12月,Pharming宣布扩大其罕见病管线,计划开发leniolisib用于治疗比APDS发病率更高的其他原发性免疫缺陷病(PIDs)。2024年10月10日,Pharming宣布启动临床试验2期概念验证研究,评估leniolisib在与PI3Kẟ信号传导相关的免疫失调的PID中的作用,临床试验将包括患有ALPS-FAS、CTLA4单倍体不足、NFKB1单倍体不足和PTEN缺陷等的PID患者。该研究是一项单臂、开放标签、剂量范围探索研究,旨在评估安全性、耐受性、药代动力学和药效学,并探索leniolisib在目标PID人群中的临床疗效。
三、OTL-105(近期已终止)
2021年,Pharming与Orchard Therapeutics签订许可协议,获得研究、开发、生产和商业化OTL-105的权利,OTL-105是一种用于治疗因缺乏C1INH而导致的HAE患者的研究性体外自体造血干细胞(HSC)基因疗法,以Orchard Therapeutics的体外自体基因治疗平台方法为基础,旨在使用HAE患者自身的造血干细胞,并将这些细胞植入HAE中减少的基因的工作拷贝中,这种新方法有可能治愈HAE患者,而无需依赖急性或预防性使用HAE药物,让患者过上正常生活。2023年10月5日,Orchard Therapeutics被日本公司Kyowa Kirin收购,Pharming随后终止了与Orchard Therapeutics的研究合作和许可协议,并停止了OTL-105项目。
为了进一步完善公司的罕见病产品组合,Pharming继续奉行以许可内购或收购临床阶段资产为主的战略。
财务状况
2024年前三季度Pharming的总收入为2.045亿美元,与上年同期相比增长25%,RUCONEST的总收入为1.726亿美元,Joenja的收入为3190万美元,以上增长主要是由交易量的增加推动的;其他收入从上年同期的2280万美元降至200万美元;毛利为1.813亿美元,与上年同期相比增加24%;2024年前九个月的运营费用增加是由于对Joenja的持续投资、在美国境外推出leniolisib的准备工作、增加研发投资以扩大leniolisib特许经营权以及由于业务增长而增加的工资支出,运营亏损为1530万美元;净亏损为1470万美元。
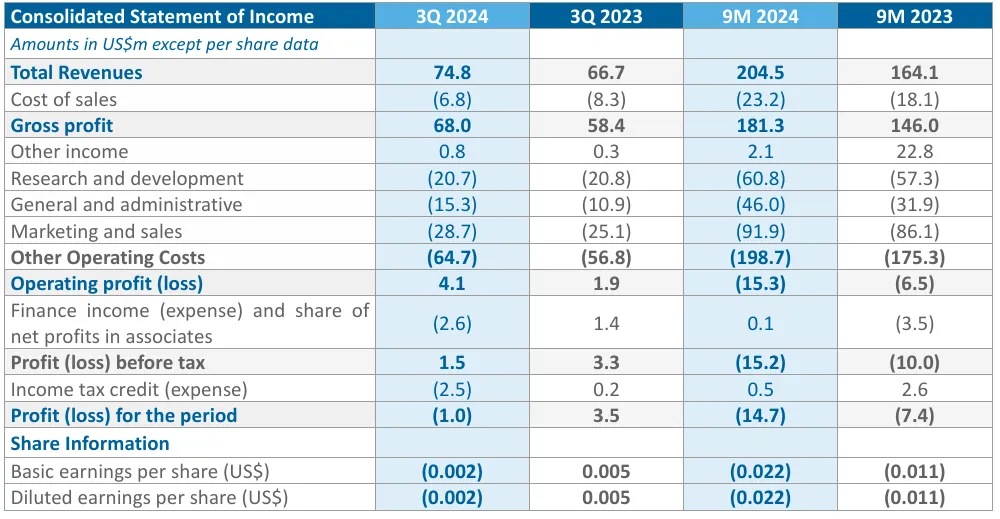
2023年度,公司总收入达到2.45亿美元,增长了19%;营业利润亏损了540万美元,而上年同期营业利润为1820万美元;净利润也呈现亏损1010万美元。
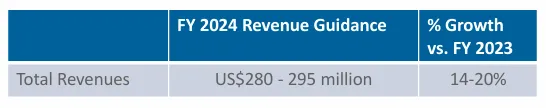
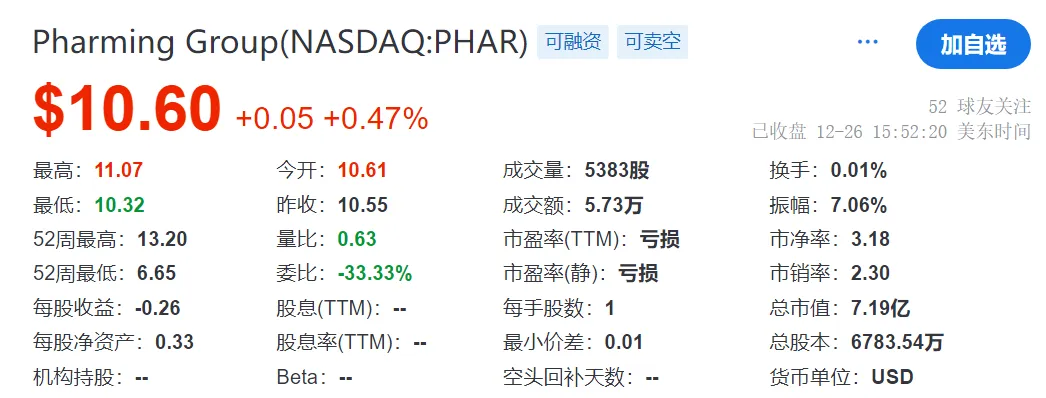
2024年9月30日,Pharming的现金和现金等价物为1.733亿美元,因为公司今年回购了1.349亿美元的未偿可转换债券和1390万美元的税款,被新发行的可转换债券的1.045亿美元净收益所抵消。对于快要结束的2024年,Pharming预计总收入在2.8~2.95亿美元之间。截止2024年12月26日,公司总市值为7.19亿美元,约合人民币52.5亿元。发稿前市值为6.58亿美元。

 产业资讯
产业资讯
 米内网
米内网  2025-11-11
2025-11-11
 20
20

 产业资讯
产业资讯
 药智网
药智网  2025-11-11
2025-11-11
 18
18

 产业资讯
产业资讯
 医麦客
医麦客  2025-11-11
2025-11-11
 22
22