 产业资讯
产业资讯
 医麦客
医麦客  2025-04-15
2025-04-15
 819
819
在癌症治疗领域,实体瘤始终是难以攻克的堡垒。当 CAR-T 疗法在血液瘤中展现「治愈奇迹」时,实体瘤因异质性强、免疫微环境复杂等难题,长期缺乏突破性疗法。而 TIL(肿瘤浸润淋巴细胞)疗法的出现,为这一困境带来转机——它依托肿瘤内天然存在的抗肿瘤 T 细胞,通过体外扩增后回输,能够精准识别多种肿瘤抗原,成为继 CAR-T 之后又一备受瞩目的细胞治疗技术。
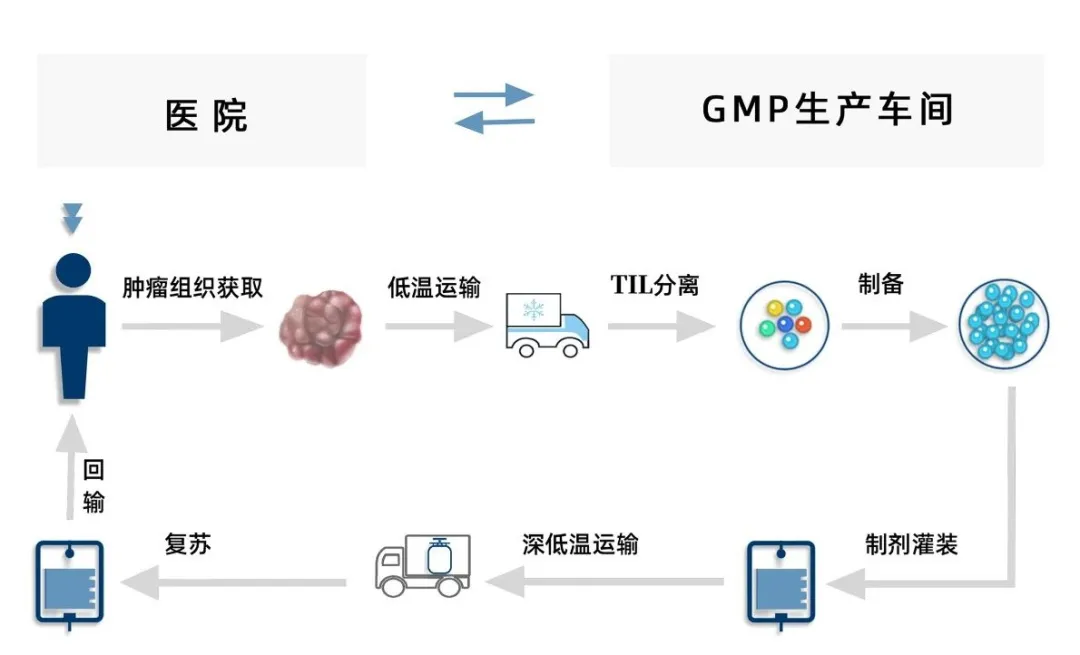
▲ 图 自体TIL疗法流程
TIL 疗法起源于 20 世纪 80 年代,美国国立卫生研究院的 Steven Rosenberg 团队首次从黑色素瘤患者肿瘤中分离出 TIL,并通过 IL-2 扩增后回输,实现了 60% 的客观缓解率(ORR)。这一技术随后被 Iovance Biotherapeutics 进行商业化开发,其核心产品 Amtagvi(Lifileucel/LN-144)于 2024 年 2 月获 FDA 批准上市,在黑色素瘤治疗中展现出 31.4% 的 ORR,成为全球首款实体瘤 TIL 疗法,也标志着该技术真正从概念走向了现实。
可喜的是,国内已有越来越多的 TIL 候选疗法在临床中展现出亮眼的数据,如华赛伯曼的 HS-IT101(FAST-TIL)在黑色素瘤中 ORR 达 50%,君赛生物的 GC101 在晚期实体瘤治疗中 ORR 超过 35%,沙砾生物的 GT101 在宫颈癌中 ORR 达 45.5%,等等。这些数据均表明,TIL 疗法在实体瘤中具有强劲的治疗潜力。
与此同时,鉴于早期的 TIL 疗法存在制备周期长、培养成功率低、对 IL-2 依赖高、患者预处理风险较大等问题,将严重影响这一疗法的临床应用,因此如何提高 TIL 疗法在临床上的应用可及性也是各家研发企业在持续探索和精进的重要方向之一。
为了更全面地观察和了解目前 TIL 疗法的研发进展,我们特别整理了国内外当前处于注册临床阶段、且有相应临床数据公布的 TIL 疗法管线,通过从临床疗效、安全性、工艺水平等多个维度,一起来领略 TIL 疗法的魅力。
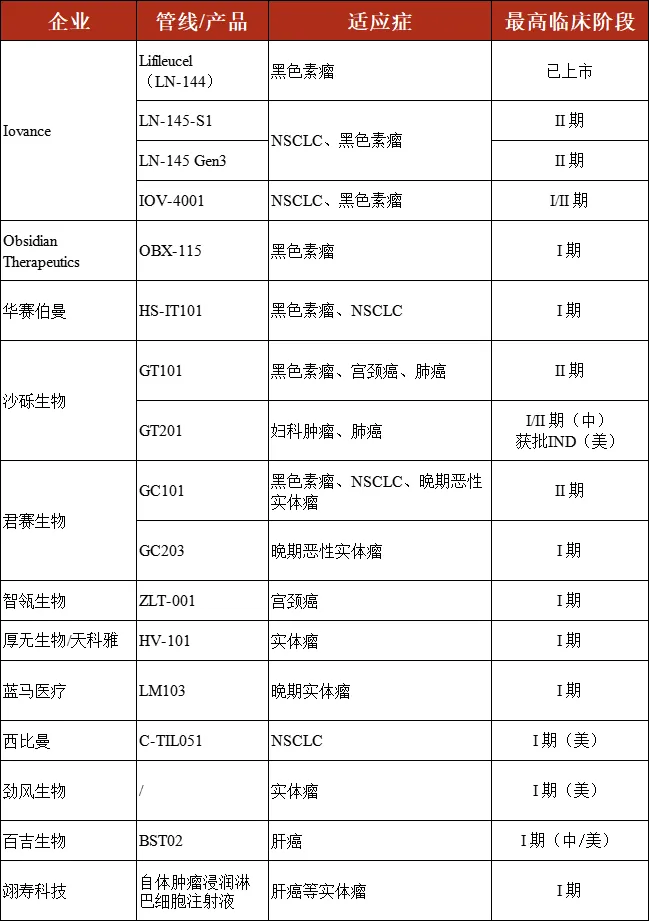
▲ 表 国内外进入注册临床阶段的代表 TIL 管线
在此需要特别说明的是,尽管目前有不少候选疗法会通过研究者发起的临床研究(IIT)进行一些早期临床探索以推动下一步创新,但出于严谨考量,本文所列举引用的临床数据仅限于已公开的注册临床阶段数据。
因为注册性临床试验经过了更为严格的监管审评,无论是其审评机构的权威性、周期与严谨性,均远在 IIT 之上。并且注册性临床在流程与方案的执行上更加标准化,其核心目标是为产品上市提供依据,因此疗效评估需锚定严格终点,数据需通过统计学验证并满足监管标准,这也就确保了数据的可重复性与有效性。
产品/管线:Lifileucel
研发企业:IOVANCE
适应症:黑色素瘤
Lifileucel 作为一种自体 TIL 疗法,通过从患者的肿瘤组织中收集和扩增 TIL 细胞,而后再将数十亿 TIL 细胞重新静脉输注到患者体内,以达到杀死肿瘤的目的。根据 Iovance 公司的公开信息,其整个制造过程大约需要 34 天。
在 Lifileucel 的多中心 2 期临床研究 C-144-01(NCT02360579)中,总计入组 153 例患者。这些患者的中位年龄 56 岁,54.2% 为男性,ECOG 评分 0-1 占比 68%,基线特征复杂。
研究结果显示,整体 ORR 为 31.4%(48/153),其中完全缓解(CR)的患者占 5.9%,部分缓解(PR)的患者占 25.5%。患者的中位 OS 为 13.9 个月,12 个月 OS 率为 54.0%。
产品/管线:OBX-115
研发企业:Obsidian Therapeutics
适应症:黑色素瘤
OBX-115 是 Obsidian Therapeutics 在研的一款经过基因工程改造的 TIL 疗法,通过基因修饰使 TIL 表达膜结合型 IL-15(mbIL15),其活性可由小分子药物乙酰唑胺(ACZ)诱导,从而替代传统 TIL 疗法中高剂量的 IL-2,有效减少了传统 TIL 疗法依赖 IL-2 所造成的毒副作用。
在 OBX-115 针对 ICI 耐药晚期黑色素瘤的 Ⅰ 期临床研究中,总计评估了 9 例患者。其整体 ORR 为 44.4%,其中 2 例患者达到了 CR,2 例患者达到了 PR,疾病控制率(DCR)100%,无进展生存期(PFS)达 24 周,PFS 率为 75%。
产品/管线:HS-IT101(FAST-TIL)
研发企业:华赛伯曼
适应症:黑色素瘤
FAST-TIL 是华赛伯曼基于自主研发的 PowerTexp®高效 TIL 生产工艺平台开发的首款 TIL 细胞治疗产品,具有生产快、样本需求量少等特点。其生产周期最快可缩短至-(13)天,是目前行业公开的最短周期。
在所需样本量的技术上也有大幅提升,仅需 0.05 g 样本,远小于行业平均水平。同时,FAST-TIL 的生产系统也更为先进,率先引入了全自动化全封闭培养工艺,使得产品的稳定性有了更高保障。
在临床应用方面,FAST-TIL 给药患者 IL-2 的使用量仅为 Lifileucel 的 1/25,并且干性细胞比例也更高,是 Lifileucel 的 2 倍。综合以上多重优化因素,FAST-TIL 的生产成本估算仅为 Lifileucel 的 1/10 ,这对未来的商业化奠下了良好的基础。
目前,FAST-TIL 的 I 期临床试验(CTR20234065)正在快速推进中,并且已显示出良好的安全性和显著的疗效。截至 2025 年 3 月披露的数据,FAST-TIL I 期临床已入组并完成肿瘤评估的 6 例晚期黑色素瘤患者中有 3 人取得客观缓解,ORR 为 50%,DCR 100%。
此外,华赛伯曼还有 FAST-TIL 联合 PD-1、NICE-TIL(HS-IT201)等 TIL 疗法在研管线进展到 IIT 阶段。

▲ 图 华赛伯曼在研 TIL 疗法管线
产品/管线:LN-145
研发企业:IOVANCE
适应症:宫颈癌、非小细胞肺癌
LN-145 同样是由 IOVANCE 开发的一款 TIL 疗法,它的适应症为宫颈癌和非小细胞肺癌。该疗法从患者体内获取肿瘤组织,提取其中的 TIL,然后在体外利用 IL - 2 细胞因子刺激 TIL 扩增。
LN-145 在针对复发、转移或持续性宫颈癌的 Ⅱ 期研究(NCT03108495)中,总计入组 27 例均接受过≥1 线治疗的患者。研究数据显示,整体 ORR 达到 44.4%,其中 11.1%(3 例)达到 CR,9 例患者达到 PR,DCR 达到 85.2%,78% 的患者靶病灶直径总和减少。
在针对转移性非小细胞肺癌(mNSCLC)的 Ⅱ 期多中心临床研究(NCT03645928)中,总计入组 28 例 ICI 治疗后进展的 mNSCLC 患者。结果显示,ORR 为 21.4%,有 1 例患者达到 CR,5 例患者达到 PR,79.2% 的患者肿瘤负荷有所降低。
在联合派姆单抗针对未接受过 ICI 治疗的 mNSCLC 的 3A 队列研究(NCT03645928)中,总计入组 19 例患者。数据显示,ORR 达到 42.1%(8/19),2 例患者达到 CR,6 例患者达到 PR,DCR 达到 78.9%,76.5% 患者靶病灶直径总和减少。
产品/管线:GT101
研发企业:沙砾生物
适应症:宫颈癌
GT101 是沙砾生物依托其 StemTexp® 干性 TIL 扩增技术平台开发的一款 TIL 疗法,培养制备过程约 30 天左右。患者在接受治疗时,需依次进行非清髓性淋巴细胞清除方案、GT101 回输以及 IL - 2 注射。
沙砾生物在 ASCO 2024 上公布了 GT101 的 I 期临床试验(NCT05430373)数据。截至当时,该研究共入组 14 名多线治疗失败的实体瘤患者,包含如小细胞肺癌、黑色素瘤和宫颈癌在内的多种实体瘤。在宫颈癌亚组(n=11)中,GT101 的 ORR 达到 45.5%,DCR 达到 90.9%,其中 1 例患者的肿瘤被完全清除。
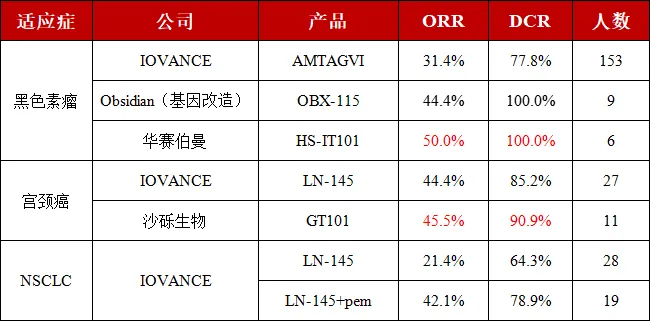
▲ 表 部分公开的 TIL 疗法注册临床数据
通过对以上几款代表性管线临床数据的简单整理,我们可以欣喜地看到,国产 TIL 正通过自身的不断优化与迭代,成为全球的领跑者。当然,由于国内在 TIL 疗法的研发赛道中起步相对较晚,目前所积累的临床数据还相对较少。但我们相信后来者居上,青出于蓝可胜于蓝。国内有着丰富的临床资源,我们期待在不久的将来能够看到这些数据的不断完善与验证。
结 语
从 Rosenberg 的实验室突破到 Iovance 的商业化破冰,再到以华赛伯曼为代表的中国企业在自动化生产、疗效提升上的创新突围,TIL 疗法正迎来「精准化、高效化、可及化」的黄金发展期。细胞治疗的浪潮从血液瘤涌向实体瘤,TIL 疗法则以「源于肿瘤、靶向肿瘤」的天然属性,成为破局的关键。
随着全球研发管线的持续推进,我们有理由期待,TIL 疗法或将有一天站在临床前线为更多癌症患者带来生存的希望。

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 27
27

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 38
38

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 29
29