 研发追踪
研发追踪
 药时空
药时空  2025-07-22
2025-07-22
 3602
3602
干细胞作为一类具有自我更新和多向分化潜能的细胞,在再生医学、疾病治疗等领域展现出巨大的潜力。近年来,随着技术的不断进步和研究的深入开展,干细胞治疗逐渐从实验室走向临床应用。
6月5日,我国首款获批上市的干细胞药物艾米迈托赛注射液(睿铂生)首张处方在北京大学人民医院黄晓军院士团队开出,用于单倍体移植患者治疗。这标志着我国干细胞药品正式开启商业化临床应用。本文主要统计了2025年上半年干细胞药物IND申报及获批情况。
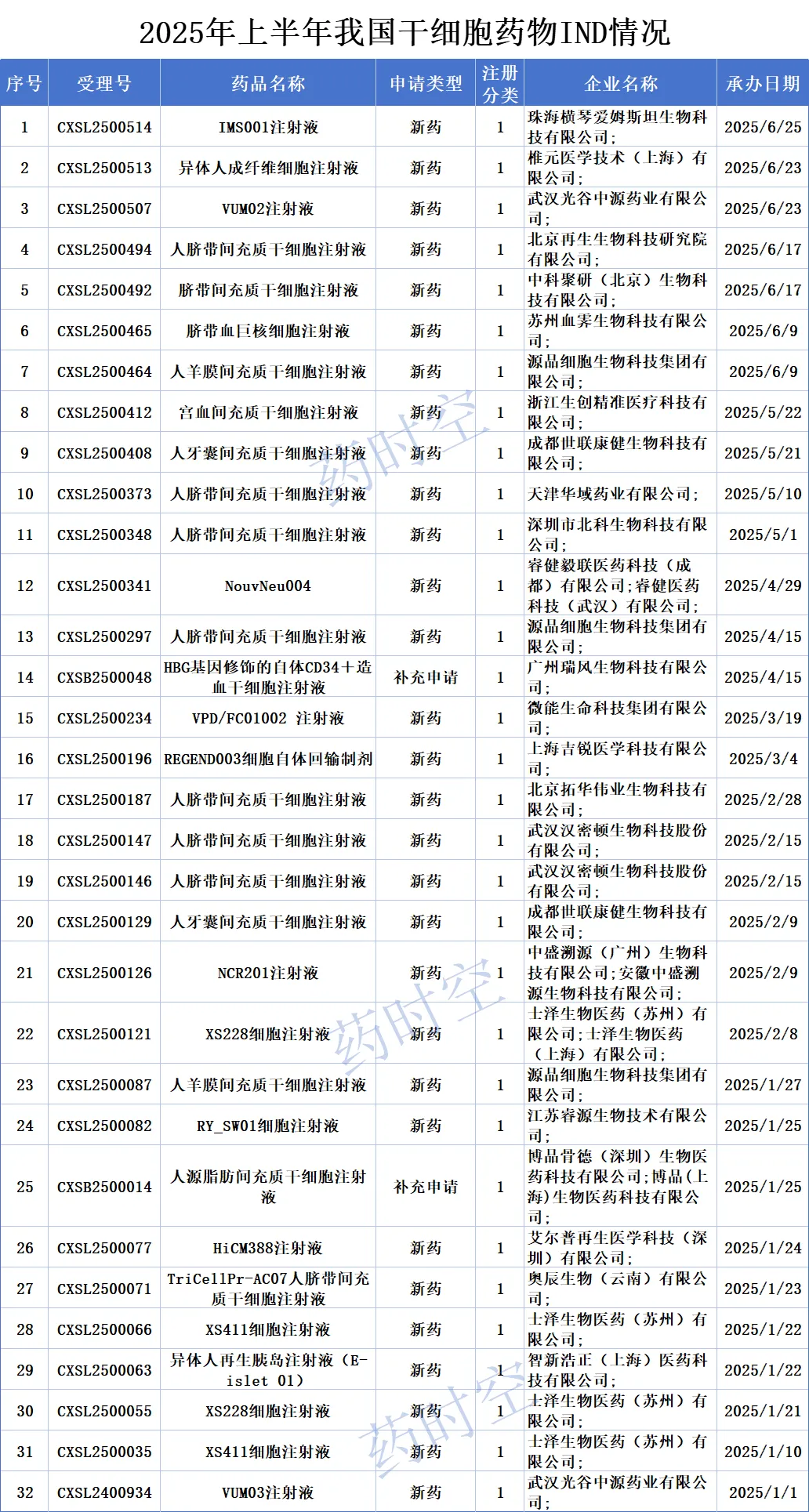
一、2025年上半年干细胞药物IND情况
今年上半年,CDE共受理了27款干细胞药物(受理号32个),其中有2款申请类型为补充申请,其余均为新药申请。
1、每月申请数量情况
从每月的IND申请数量来看,1月份IND受理数量最多,有10项干细胞药物申请获受理,占上半年总数的31%;其次是6月和2月,分别有7项和6项干细胞药物申请获受理;其他月份获得临床受理的干细胞药物数量则均在5项以下。
2、申报的干细胞药物种类情况
常用的干细胞分为胚胎干细胞(embryonic stemcell,ESC)、间充质干细胞(mesenchymal stem cells,MSC)、造血干细胞(hematopoietic stem cells,HSC)和诱导多能干细胞(induced pluripotent stem cells,iPSC)。
今年上半年申报临床的干细胞药物中,间充质干细胞类药物数量最多,有16款(受理号19个)。间充质干细胞是成体干细胞,具有高扩增能力、多分化潜能,能修复多种组织器官。常见的间充质干细胞类型有骨髓间充质干细胞、脂肪间充质干细胞和脐带血间充质干细胞等。间充质干细胞输人途径多样、免疫排斥反应低、取材方便且涉及伦理问题少。
实际上,在全球范围内,间充质干细胞药物的临床研发阶段已经取得了显著进展。据公开数据统计,已有655个间充质干细胞药物进入了临床研发阶段,遥遥领先于其他类型的干细胞疗法。
值得注意的是,6月5日,我国首款获批上市的干细胞药物艾米迈托赛注射液(睿铂生)首张处方在北京大学人民医院黄晓军院士团队开出,用于单倍体移植患者治疗。这标志着我国干细胞药品正式开启商业化临床应用。该药物也是我国首款获批上市的间充质干细胞(MSCs)治疗药品。
除了间充质干细胞类药物外,今年上半年申报临床的干细胞药物还包括多能干细胞(iPSC)药物、造血干细胞药物、亚全能干细胞疗法、自体肾源干细胞疗法等。
3、企业申报药物数量情况
从申报企业来看,今年上半年干细胞药物IND申请中,土泽生物医药(苏州)有限公司申报数量最多,共提交了4项IND,设计两款干细胞药物——XS411细胞注射液和XS228细胞注射液,前者为异体通用“现货型”iPSC衍生亚型多巴胺能神经前体细胞新药,后者为异体通用“现货型”iPSC衍生亚型神经前体细胞新药。
此外,源品细胞生物科技集团有限公司、武汉光谷中源药业有限公司、成都世联康健生物科技有限公司也有不止一项IND申请获受理,且这些企业所涉及的药物均为间充质干细胞产品。
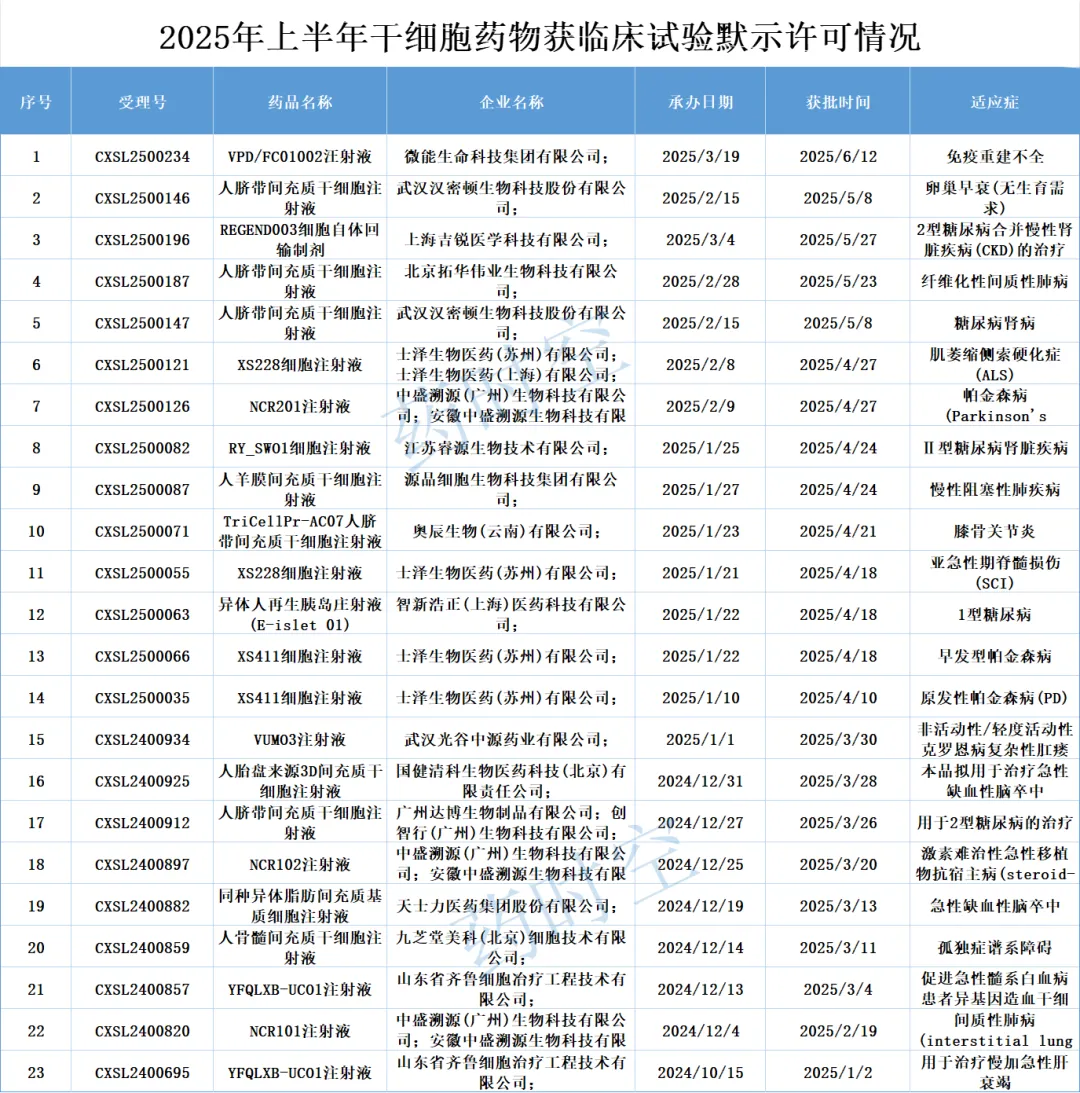
二、2025年上半年干细胞药物获临床试验默示许可情况
今年上半年,共有23款干细胞药物获得临床试验默示许可。
1、每月获批数量情况
从每月获批临床的药物数量来看,4月最多,有9款药物获批临床;随后分别是3月和5月,分别有7款和4款干细胞药物获批临床;其他月份则均仅有1款获批临床。
2、获批的干细胞药物种类情况
在这23款获批临床的干细胞药物中,间充质干细胞依旧占比最多,有14款,其中有10款都是脐带来源,其余则是羊膜、胎盘、脂肪、骨髓来源。此外较多的则是诱导多能干细胞药物。
3、获批企业情况
士泽生物依旧是获批临床默示许可数量最多的企业,今年申报的4项临床申请均获批。其他获得多个临床默示许可的企业还包括中盛溯源、汉密顿、齐鲁细胞。
4、适应症情况
从申请的适应症看,主要集中在中枢神经系统(CNS)疾病、呼吸系统疾病、肾病、内分泌疾病等。此外,还有一些具有特色的适应症,例如卵巢早衰、免疫系统重建不全等。
总的来说,我国干细胞创新已从单点突破迈向全国多点开花的快速发展阶段,行业创新活力正在逐步释放。目前,“注射液”仍是主流申报剂型,间充质干细胞(MSCs)最受青睐。随着我国首款药物上市和后续产品管线不断丰富,未来3-5年有望迎来首个产业化爆发期。预计到2026年,中国干细胞市场规模将突破400亿元,成为全球再生医学领域的重要增长。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 49
49

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 44
44

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 42
42