 研发追踪
研发追踪
 药智数据
药智数据  2025-08-18
2025-08-18
 1015
1015
2025年8月12日,美国FDA批准了Insmed公司研发的Brinsupri(brensocatib),这是首个且唯一获FDA批准治疗非囊性纤维化支气管扩张症的药物。

图片来源:Insmed 官网
与常见呼吸道疾病不同,非囊性纤维化支气管扩张症(NCFB)患者的气道会永久性异常扩张,形成无法有效清除分泌物和细菌的“死腔”。这种结构改变导致反复感染和炎症循环,患者饱受频繁急性发作之苦:咳嗽加剧、脓痰增多、呼吸困难甚至咯血。每一次发作都在加速肺功能的不可逆下降。
美国约有50万确诊患者,全球患者总数估计达数百万。然而在Brinsupri获批前,临床治疗仅限于抗生素控制感染和物理排痰等对症处理,缺乏针对疾病核心机制的药物。
FDA的批准决定主要基于III期ASPEN研究的数据支持。这项大规模临床试验招募了1,680名成年患者和41名青少年患者,是NCFB领域规模最大的注册研究之一。
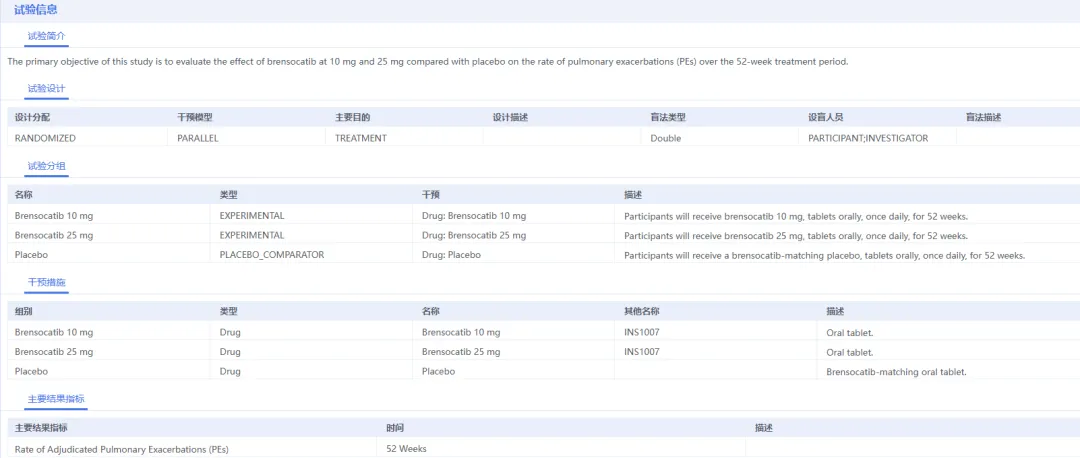
图片来源:药智数据企业版-全球临床试验数据库
试验结果显示,与安慰剂相比,每日口服10mg Brinsupri的患者年化急性发作率降低21.1%,25mg组降低19.4%。两种剂量均达到统计学显著差异(P<0.01)。
除主要终点外,该药物还达成了多项关键次要终点:接受治疗的患者首次发作时间显著延迟,一年内无急性发作的患者比例明显提高(10mg组48.5%,25mg组48.5%,安慰剂组40.3%)。
值得注意的是,25mg剂量组患者还表现出肺功能下降减缓——通过第52周时支气管扩张剂后一秒钟用力呼气量(FEV1)的测量证实。这一发现对延缓疾病进展具有重要临床意义。
安全性方面,该药物表现出可接受的风险收益比。常见不良反应包括上呼吸道感染、头痛、皮疹、皮肤干燥、角化过度和高血压,发生率均高于安慰剂组至少2%。标签中还特别提醒了皮肤、牙龈和牙周相关不良反应的风险。
Insmed公司宣布Brinsupri的年度定价为8.8万美元,尽管定价高昂,但华尔街对这款“孤儿药”的商业前景极为乐观。市场乐观情绪源于多方面:该领域存在高度未满足的医疗需求、令人信服的临床数据、医生和患者群体对创新治疗的期待。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 42
42

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 37
37

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 35
35