 研发追踪
研发追踪
 药明康德
药明康德  2025-08-27
2025-08-27
 1044
1044
近日,在美国化学会(ACS)2025秋季会议的“首次公开(first-time
disclosures)”环节中,13款已进入或即将进入人体试验的小分子药物的化学结构首次公开亮相,这些潜在的新药覆盖了镰状细胞病(SCD)、心力衰竭、癌症等多个治疗领域。这些分子不仅在结构设计上展现出显著的创新性,其独特的作用机制也为相关疾病治疗开辟了新的路径。本文将依据ACS旗下C&EN网站的报道及公开信息,向读者介绍这些创新分子结构及其研发进展。
候选药物:IID432
研发机构:诺华(Novartis)
靶点:克氏锥虫(Trypanosoma cruzi)拓扑异构酶II
适应症:美洲锥虫病(Chagas disease)
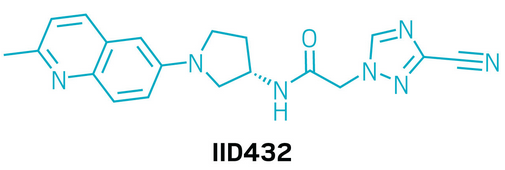
▲IID432的结构式(图片来源:参考资料[1])
IID432是一款在研小分子,用于治疗美洲锥虫病。美洲锥虫病长期困扰全球数百万患者,但现有疗法往往疗程较长,疗效不稳定且安全性不足。为寻找更理想的方案,研究人员在诺华化合物库中通过表型筛选,发现了一类对锥虫寄生虫具有快速杀灭作用的氰基三唑化合物。经过进一步优化,团队为美洲锥虫病定制靶向药物的核心结构,不仅提升了活性,还降低了对大脑的影响,显著提高了疗效。研究显示,该类化合物可选择性抑制克氏锥虫的拓扑异构酶II,从而阻断DNA复制。在这一系列化合物中,IID432表现尤为突出。它在体外实验中展现出极强活性(EC50仅8 nM),并能在停药后实现无复发的寄生虫清除。在小鼠模型中,单次口服25 mg/kg剂量即可实现治愈,即便在免疫抑制状态下仍保持疗效。此亮眼结果显示出其作为根治疗法的潜力。目前,IID432已顺利完成大鼠和猴子安全性研究,即将进入临床1期试验阶段。
候选药物:BMS-986470
研发机构:百时美施贵宝(Bristol Myers Squibb)
靶点:ZBTB7A和WIZ
适应症:镰状细胞病
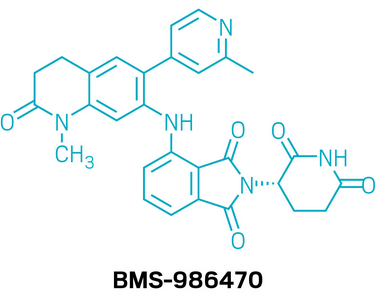
▲BMS-986470的结构式(图片来源:参考资料[1])
BMS-986470是一款旨在解决镰状细胞病长期未满足的治疗需求的药物。该疾病由β-珠蛋白基因突变引起,导致血红蛋白异常,在缺氧状态下容易聚集,使红细胞变形,继而引发疼痛危机和溶血。研究表明,提升胎儿血红蛋白(HbF)水平能够抵消异常血红蛋白的聚集,从而改善疾病症状。部份传统药物虽能增加HbF水平,但疗效差异大,且存在耐受性与毒性限制。科学家通过表型筛选发现了一类能够调控CRBN通路的化合物,其中BMS-986470表现最为突出。它通过促进主要驱动γ-珠蛋白基因沉默的ZBTB7A和WIZ蛋白降解,从而显著提高HbF水平。动物实验显示,该药物在猴子试验中实现了剂量依赖性的HbF水平提升,且未对红细胞分化产生不良影响。这些结果为其临床潜力提供了坚实依据。目前,BMS-986470已进入1期临床研究。
候选药物:GS-1427
研发机构:吉利德科学(Gilead Sciences)
靶点:α4β7整合素
适应症:炎症性肠病(IBD)
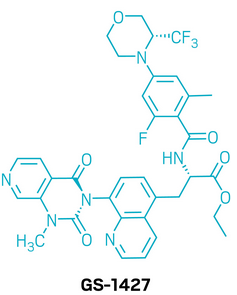
▲GS-1427的结构式(图片来源:参考资料[1])
IBD的发生与肠道T细胞的异常聚集密切相关,而α4β7整合素正是介导这一过程的关键分子。它通过与肠道内皮细胞上的MadCAM-1结合,引导T细胞迁移至发炎组织。已有的抗体药物通过阻断这一结合,已在临床中得到验证。然而,抗体治疗存在需要静脉给药、免疫原性风险等局限,因此开发口服小分子抑制剂成为更具吸引力的方向。GS-1427正是基于这一机制设计的候选药物。它能以皮摩尔级活性高效阻断α4β7与MadCAM-1的相互作用,并具有高度选择性。在动物实验中,GS-1427表现出与抗体相当的体内活性,能够有效减少T细胞进入肠道发炎区域,并在小鼠IBD模型中展现出显著疗效。其优势在于口服给药的便利性,以及不引发广泛免疫抑制,具备与其他疗法联合使用的潜力。目前,GS-1427已进入溃疡性结肠炎的2期临床试验。
候选药物:PF-07899895
研发机构:辉瑞(Pfizer)
靶点:SIK1-3
适应症:IBD
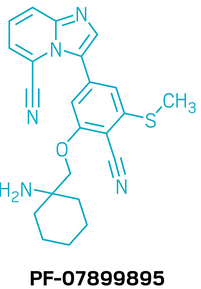
▲PF-07899895的结构式(图片来源:参考资料[1])
SIK1-3在免疫细胞中发挥双重作用,一方面促进炎症反应,另一方面又抑制免疫调节因子的产生。因此,通过抑制SIK活性,可以在降低过度炎症的同时增强免疫耐受,从而为IBD治疗提供新的解决思路。考虑到全身范围内的SIK抑制可能带来的副作用,研究团队采用了定向于结肠的策略:通过分子设计与改良释放技术,使药物在结肠组织中实现高效的SIK抑制,而在血液循环中的药物浓度则被尽量降低,以提升安全性。在研发过程中,科学家利用已有的化学分子结构作为基础,结合结构导向的药物设计,展开一系列优化工作。最终获得了一款兼具高效力、良好溶解度和透过性的候选药物PF-07899895。该化合物不仅在体外表现出强效的全SIK抑制活性,还在动物模型中验证了显著的治疗效果。目前,这一结肠靶向的泛SIK抑制剂已进入1期临床试验。
候选药物:AZD0233
研发机构:阿斯利康(AstraZeneca)
靶点:CX3CR1
适应症:心血管疾病
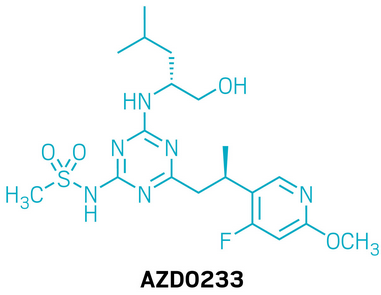
▲AZD0233的结构式(图片来源:参考资料[1])
AZD0233是一款靶向趋化因子受体CX3CR1的新型小分子药物。CX3CR1受体存在于单核细胞、巨噬细胞、自然杀伤细胞和记忆效应T细胞表面,其唯一配体为CX3CL1(fractalkine)。在心力衰竭患者中,心脏组织内CX3CR1/CX3CL1的表达显著升高,提示通过阻断该通路实现免疫调节,有望改善心脏功能。AZD0233正是在这一背景下研发的新一代CX3CR1拮抗剂。相比早期分子,它具备更优越的理化性质、更稳定的代谢表现、更低的毒性风险。在扩张型心肌病小鼠模型中,AZD0233能够提升心脏收缩功能,减少心脏巨噬细胞浸润及纤维化瘢痕形成,显示出良好的治疗潜力。同时,该药物在动物实验中耐受性良好。当前,AZD0233已进入1期临床试验的单次递增剂量与多次递增剂量(SAD/MAD)研究阶段。
候选药物:PF-07293893
研发机构:辉瑞(Pfizer)
靶点:AMPKγ3
适应症:心力衰竭
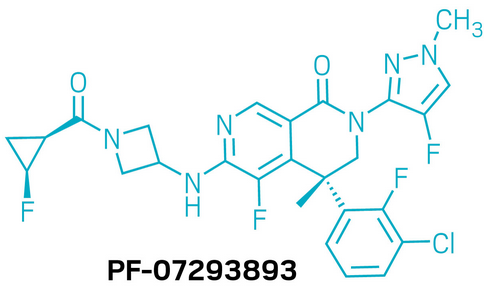
▲PF-07293893的结构式(图片来源:参考资料[1])
PF-07293893是一款新型、选择性作用于AMPKγ3亚型的激活剂,用于治疗心力衰竭。AMPK作为细胞能量代谢的关键调控因子,在促进脂肪酸合成、线粒体生成等过程中发挥重要作用,因此成为多种疾病的重要靶点。研究团队最初通过片段筛选发现了早期先导化合物,但因其药代动力学性质不佳,无法在体内开展研究。为克服这一限制,科研人员采用创新的药物化学策略,对分子结构进行了全面重新设计,建立了新的化合物系列,并首次在动物体内观察到活性。在此基础上,团队结合结构导向的药物设计与构象限制等优化手段,显著提高了分子的效力,并有效减少了非靶点作用。与此同时,药代动力学性能也得到全面改善。最终,PF-07293893脱颖而出,成为进入临床开发的候选药物。在前期研究中,该分子表现出良好的选择性和体内药效。目前,PF-07293893已完成1期临床试验。
候选药物:[11C]MK-7337
研发机构:默沙东(MSD)
靶点:α-突触核蛋白(????-synuclein)
适应症:帕金森病(显影剂)
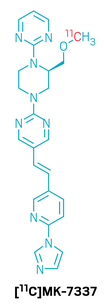
▲[11C]MK-7337的结构式(图片来源:参考资料[1])
[11C]MK-7337是一款新型正电子发射断层显像(PET)放射性配体,专门用于帕金森病相关α-突触核蛋白病理的成像。帕金森病的典型特征是脑内异常聚集的α-突触核蛋白形成路易小体。早期、准确地识别这一病理变化对于及时干预、延缓疾病进程具有重要意义。然而,与阿尔茨海默病的淀粉样蛋白和tau成像取得成功不同,帕金森病的病理影像开发长期面临挑战:一是脑内靶点密度远低于阿尔茨海默病,二是聚集蛋白结构相似性导致选择性不足,三是难以获得高结合力的探针。为突破这一瓶颈,研究团队通过高通量筛选获得苗头化合物,并逐步优化亲和力、理化性质和选择性,最终确定先导化合物。在A30P突触核蛋白过表达小鼠、非人灵长类动物以及相关人类组织的实验中,先导分子均表现出理想的结合特性。该化合物目前已展开了首次人体临床成像研究,以验证其在中轻度帕金森病患者中检测病理相关影像的可行性。
候选药物:FOG-001
研发机构:Parabilis Medicines
靶点:β-catenin/TCF4相互作用
适应症:实体瘤
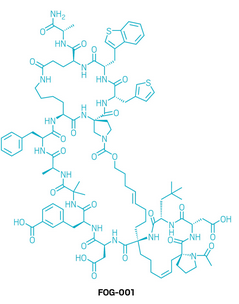
▲FOG-001的结构式(图片来源:参考资料[1])
FOG-001是一款创新型肽类药物,旨在解决长期困扰肿瘤治疗的β-catenin靶点难题。Wnt信号通路的异常激活在至少15%的癌症中出现,且常与预后不良及免疫治疗耐药相关。然而,β-catenin位于细胞内部,既无法被抗体等生物大分子直接作用,也缺乏典型的小分子结合位点,因此长期被视为“不可成药”靶点。研究团队通过设计超稳定的α-螺旋肽(helicons),成功开发出FOG-001。该分子在骨架上引入多重环化结构,以保持稳定螺旋构象,并通过一系列修饰,实现脂溶性调控和细胞质暴露。同时,在与β-catenin结合的关键位点引入非天然氨基酸,使其具备皮摩尔级结合力。FOG-001能够阻断β-catenin与TCF转录因子的相互作用,从而抑制Wnt信号通路,并在依赖该通路的细胞中显著抑制增殖,而对β-catenin缺失细胞无影响。药代动力学研究显示,FOG-001具备每周给药的潜力,且避免了常见肽类药物的快速经肾清除问题。在体内实验中,它不仅有效调控AXIN2、c-MYC等下游基因,还在多种携带Wnt通路突变的患者来源移植瘤模型中实现肿瘤回缩,且耐受性良好。目前,FOG-001已进入1/2期临床试验。
候选药物:TYRA-200
研发机构:Tyra Biosciences
靶点:FGFR2
适应症:胆管癌
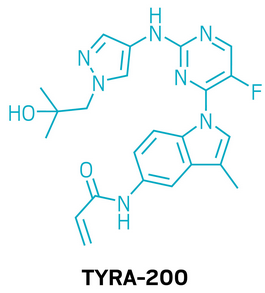
▲TYRA-200的结构式(图片来源:参考资料[1])
TYRA-200是一款专门靶向FGFR2的新型共价抑制剂,旨在突破现有疗法面临的耐药瓶颈。FGFR2在细胞发育、分裂和分化过程中发挥重要作用,其基因变异已被证实与肝内胆管癌(iCCA)的发生发展密切相关,其中约10%–15%的iCCA患者存在FGFR2融合。近年来,泛FGFR抑制剂的获批为局部晚期或转移性胆管癌患者提供了新的治疗选择。然而,这些药物的疗效常因多克隆耐药突变而受限,尤其集中在FGFR2激酶结构域的关键位点。为解决这一挑战,研究团队采用结构导向设计,开发了TYRA-200。这一分子不仅能抑制野生型FGFR2,还能覆盖几乎所有临床上已发现的耐药突变位点。在临床前研究中,口服TYRA-200在多种FGFR2及其突变驱动的肿瘤模型中均表现出显著的剂量依赖性抑瘤效果。目前,TYRA-200已进入1期临床试验,重点靶向携带FGFR2基因变异且在标准治疗中出现耐药的晚期或转移性iCCA患者。
候选药物:MOMA-341
研发机构:Moma Therapeutics
靶点:WRN
适应症:晚期或转移性实体肿瘤
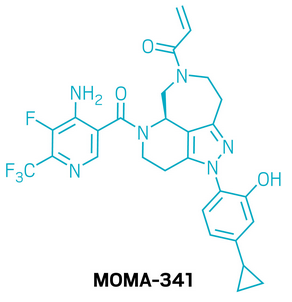
▲MOMA-341的结构式(图片来源:参考资料[1])
MOMA-341是一款具高选择性的共价抑制剂,靶向WRN蛋白。研究表明,在具有高微卫星不稳定性(MSI-H)的肿瘤中,WRN对于肿瘤细胞的生存至关重要,而在正常组织中并非必需,因此通过抑制WRN,有望实现对肿瘤的精准打击并降低对正常细胞的影响。MOMA Therapeutics通过其KNOMATIC平台,专注于动态蛋白的抑制剂研发,结合深度结构解析和定制化筛选策略,成功发现了作用于WRN的全新抑制剂类别。在研发过程中,团队利用DNA编码化合物库筛选出可诱导WRN非活性构象的可逆性变构抑制剂,并进一步设计了基于结合口袋中半胱氨酸727的共价化合物。通过精确优化共价基团的结合轨迹、提升可逆结合亲和力,同时保持分子稳定性,研究人员显著增强了抑制效率。由于WRN结合口袋高度灵活,采用骨架刚性化设计提升了目标结合效果,并在此基础上优化了分子的效力和药代动力学性质。最终,MOMA-341被确立为临床候选药物。在多种MSI-H的异种移植瘤模型中,口服低剂量MOMA-341即可显著抑制肿瘤生长。目前,该药物已进入1期临床试验。
候选药物:ETN029
研发机构:Mariana Oncology
靶点:DLL3
适应症:小细胞肺癌(SCLC)、神经内分泌型前列腺癌(NEPC)
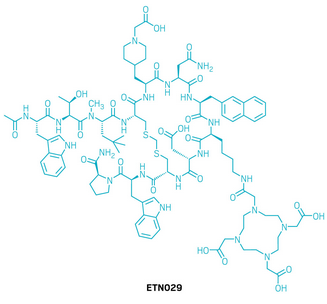
▲ETN029的结构式(图片来源:参考资料[1])
ETN029是一款新型大环肽类药物,专门靶向非典型Notch配体DLL3。DLL3在SCLC、NEPC等肿瘤细胞表面高度选择性上调,但其表达密度较低,给药物开发带来挑战。研究团队针对这一难点,设计了结合力极强且解离速率极慢的大环肽分子,以增强肿瘤结合效率。早期化合物虽具备一定的肿瘤靶向性,但存在摄取不足和肾脏聚集过高的问题。在结构优化过程中,利用复合物晶体学分析进一步完善了分子设计,获得候选药物ETN029。该分子对人DLL3具有皮摩尔级亲和力与高度特异性,在SHP-77及DLL3表达的细胞系中均表现出显著的结合和内吞作用,而在阴性对照细胞中几乎无结合。在SHP-77异种移植瘤小鼠模型中,ETN029放射性偶联物可快速富集并长时间滞留于肿瘤组织。在多个动物模型中,单次低剂量ETN029放射性偶联物即可诱导显著肿瘤回缩并延长生存期。ETN029目前正在1期临床试验中接受评估。
候选药物:LRK-4189
研发机构:Larkspur Biosciences
靶点:PIP4K2C
适应症:微卫星稳定型结直肠癌
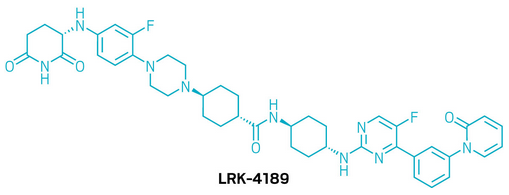
▲LRK-4189的结构式(图片来源:参考资料[1])
LRK-4189是一款潜在”first-in-class”的口服小分子降解剂,专门靶向脂质激酶PIP4K2C,用于治疗微卫星稳定型结直肠癌及其他实体瘤。癌细胞在压力环境下往往通过多种适应机制来逃避细胞死亡,而PIP4K2C已被证实与结直肠癌、乳腺癌等多种肿瘤的不良预后密切相关。肿瘤细胞通过利用PIP4K2C提升生存能力,避免免疫监视并耐受压力。LRK-4189能够选择性降解PIP4K2C,在人体原代细胞中展现出亚纳摩尔级的高效活性。在体内实验中,LRK-4189表现出剂量依赖性的药代动力学和药效学特征,作为单药即可在多种结直肠癌模型中产生明显疗效,并与一线化疗药物展现出协同作用。在来源于患者的肿瘤类器官模型中,约50%的样本对LRK-4189有应答,且微卫星稳定型结直肠癌的应答率优于对照获批药物(35%)。目前,LRK-4189已完成IND申请所需的前期研究,计划于2025年第四季度启动1期临床试验。
候选药物:BMS-986463
研发机构:百时美施贵宝
靶点:WEE1
适应症:实体瘤
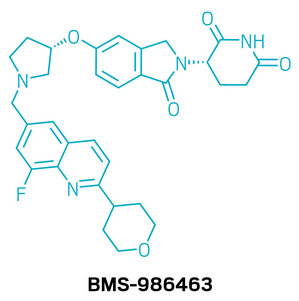
▲BMS-986463的结构式(图片来源:参考资料[1])
BMS-986463是一款潜在”first-in-class”的WEE1靶向蛋白降解剂。WEE1是一种关键的细胞周期调控激酶,主要功能是在S期和G2/M期阻止带有DNA损伤的细胞进入有丝分裂。多种高复制压力的肿瘤被认为高度依赖WEE1生存,因此成为颇具吸引力的抗癌靶点。研究团队基于专有CELMoD分子库,筛选并优化出多个WEE1降解剂化合物,并结合结构导向设计,解析了WEE1-CRBN-DDB1三元复合物结构,从而获得高效且选择性极佳的候选分子。在小鼠与大鼠异种移植瘤模型中,BMS-986463表现出显著的抑瘤效果,并建立了清晰的药代、药效与疗效关系,伴随持续的WEE1降解和磷酸化CDK2降低。目前,BMS-986463已进入1期临床试验,针对多种晚期实体瘤展开评估。
随着2025年美国化学学会秋季会议的圆满落幕,这13款创新小分子药物的公开亮相,彰显了业界在多个治疗领域持续探索创新突破的努力。我们期待这些候选药物能够在后续研究中展现出良好的临床潜力,为患者带来更多治疗选择。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 35
35

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 32
32

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 31
31