 研发追踪
研发追踪
 新药来了
新药来了  2025-09-03
2025-09-03
 1652
1652
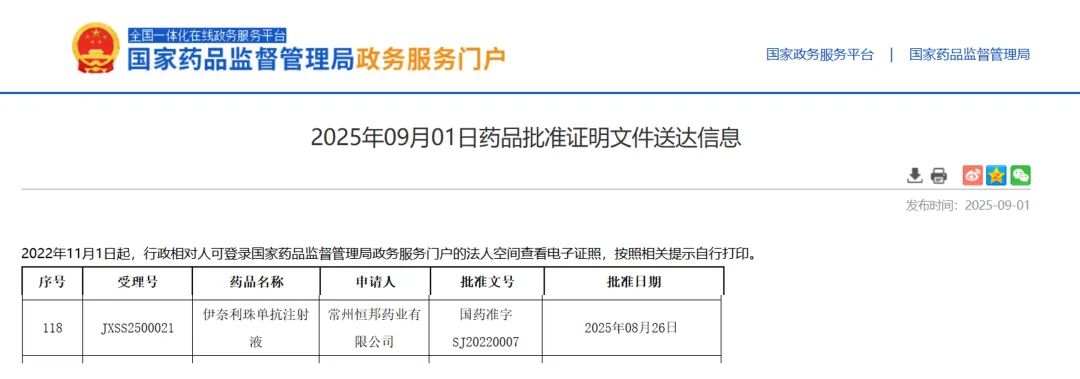
2025年 9 月 1 日,国家药监局官网更新显示:伊奈利珠单抗注射液(通用名 inebilizumab)正式获批新适应症,用于治疗免疫球蛋白 G4 相关性疾病(IgG4-RD)。
新药简介
伊奈利珠单抗是是靶向CD19 B细胞消耗性抗体。伊奈利珠单抗分别于2020年、2021年和2022年获得美国食品药品监督管理局(FDA)、日本厚生劳动省(MHLW)和欧洲药品管理局(EMA)上市批准。
2022年3月,该药获得中国国家药品监督管理局(NMPA)批准上市,适用于抗水通道蛋白4(AQP4)抗体阳性的视神经脊髓炎谱系障碍(NMOSD)成人患者的治疗。2023年1月,该药首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录》,并于2024年11月成功续约。
新药有效性
此次NMPA批准治疗IgG4-RD,是基于其全球关键性Ⅲ期试验MITIGATE的积极结果。
该试验是首个在IgG4-RD中开展的随机、双盲、安慰剂对照试验,证实伊奈利珠单抗可通过减少患者发作来降低疾病活动。相对安慰剂组,伊奈利珠单抗使疾病发作风险降低87%。
此外,新药涉及研究还包括全球多中心 III 期 MINT 研究。MINT试验(NCT04524273)是一项随机、双盲、安慰剂对照、平行分组Ⅲ期研究,评估伊奈利珠单抗治疗成人gMG的疗效与安全性。试验纳入238例成人gMG患者,包括190例AChR+患者和48例MuSK+患者。其中MuSK+组随访26周,AChR+组随访52周。
在26周时研究显示,与安慰剂相比,伊奈利珠单抗治疗组患者的MG-ADL评分下降幅度更大(最小二乘均值分别为-4.2和-2.2,差异-1.9,95% CI: -2.9至-1.0,P<0.001);在QMG评分方面,伊奈利珠单抗组的下降幅度同样明显优于安慰剂组(最小二乘均值为-4.8和-2.3,差异-2.5,95% CI: -3.8至-1.2,P<0.001)。在AChR+群体中,这一疗效的显著性表现得尤为突出。
试验还评估了AChR+组患者第52周时重症肌无力日常活动量表(MG-ADL)评分较基线的变化,伊奈利珠单抗组相较安慰剂组持续显示更优疗效(校正后差异为-2.8,95% CI: -3.9至-1.7)。伊奈利珠单抗组AChR+患者中72.3%实现MG-ADL评分≥3分改善,安慰剂组为45.2%。
第52周时,伊奈利珠单抗组定量重症肌无力量表(QMG)评分较基线改善亦优于安慰剂组(校正后差异-4.3,95% CI: -5.9至-2.8)。伊奈利珠单抗组AChR+患者中69.2%实现QMG评分≥3分改善,安慰剂组为41.8%。
新药安全性
研究期间未发现新的安全性信号,不良事件(TEAE)特征与获批适应症(NMOSD)已知安全性特征一致,最常见不良事件包括输液相关反应、鼻咽炎及尿路感染。
疾病简介
IgG4相关性疾病(IgG 4-RD)是近年来新定义的一种由免疫介导的慢性炎症伴纤维化的疾病,组织病理主要表现为以IgG4 +浆细胞为主的淋巴、浆细胞浸润,并伴有席纹状纤维化、闭塞性静脉炎。早在19世纪,IgG4-RD的临床表现已有报道,因其罕见且临床表现多种多样,在经历长达一个世纪后,直至2010年才被正式命名为IgG4-RD。
此后十余年间,对IgG 4-RD的认识迅速深入,对其临床特征的描述基本完成,受累器官表现已较全面地展示。2018年该病列入我国《第一批罕见病目录》。
IgG 4-RD的流行病学研究主要来自日本和美国,我国目前尚无相关数据。2009年,日本一项IgG 4-RD的全国调查提示,IgG4-RD的发病率为0.28~1.08每10万人年,估计患病率为0.062‰。2023年,美国一项基于商业保险索赔的研究提示,IgG 4-RD的发病率2015年约0.78例每10万人年,随着对该病认识的增加及诊断能力的提高,2019年的发病率为1.39例每10万人年,2019年的患病率为0.053‰

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 36
36

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 32
32

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 31
31