 研发追踪
研发追踪
 药智网
药智网  2025-11-18
2025-11-18
 653
653
近日,Lyell Immunopharma宣布与Innovative Cellular Therapeutics(ICT,斯丹赛生物)达成合作。
根据协议,Lyell将获得LYL273(GCC19CART)在中国大陆、香港、澳门和中国台湾地区以外的全球独家权利,以强化其实体瘤CAR-T管线。
斯丹赛生物(ICT)将获得4000万美元预付款、190万股Lyell普通股,并有资格在未来获得额外现金和股权对价,以及净销售额的分层特许权使用费。额外现金包括潜在的3000万美元临床里程金、最高1.15亿美元的后期监管里程金,以及最高6.75亿美元的商业销售里程付款。
与此同时,今年以来体内CAR-T领域交易频出。这些交易意味着CAR-T疗法的主战场正从血液瘤迈向实体瘤、从体外制备迈向体内编辑。
01
实体瘤CAR-T
CAR-T细胞疗法自2017年首获FDA批准以来,凭借在血液肿瘤中的显著疗效,彻底改变了血液瘤治疗的格局。
然而,传统CAR-T在实体瘤应用中面临多重障碍:T细胞难以浸润致密肿瘤组织、免疫抑制性微环境导致T细胞耗竭,以及脱靶毒性风险。
不过,这一僵局或将在今年被打破。
斯丹赛生物GCC19CART是一款新型的鸟苷酸环化酶-C(GCC)靶向自体CAR-T细胞候选药物,正在开发用于治疗转移性结直肠癌(mCRC)和其他表达GCC的实体瘤。
其在美国进行的1期临床试验显示,针对三线及以上R/R mCRC患者,GCC19CART在高剂量水平下具有良好的安全性和有效性。
在高剂量组(2x10^6 CAR-T/kg),客观缓解率(ORR)达到80%(4/5),3例患者达到部分缓解(PR),1例达到病理完全缓解(pCR)。中位缓解持续时间(mDoR)为6.9个月。
安全性放方面,未观察到3级或以上细胞因子释放综合征(CRS);一名受试者经历短暂的3级免疫效应细胞相关神经毒性综合征(ICANS),两名受试者出现3级腹泻。一例患者发生了剂量限制性毒性,即5级败血症,但与GCC19CART无直接关联。
这些结果表明,GCC19CART在高剂量水平下具有良好的安全性和有效性,有望成为治疗三线或以上复发/难治转移性结直肠癌的潜在同类首创疗法。
除了GCC19CART,还有更多实体瘤CAR-T候选产品值得关注。
科济药业的舒瑞基奥仑赛注射液(CT041)的确证性II期临床试验显示,在CLDN18.2表达阳性、至少二线治疗失败的G/GEJC患者中,CT041较标准治疗可显著改善PFS(mPFS 3.25个月vs 1.77个月;HR 0.366,95%CI:0.241,0.557;p<0.0001),并展现出有临床意义的OS获益(mOS 7.92个月vs 5.49个月;HR 0.693,95%CI:0.457,1.051;单侧p=0.0416)。同时CT041具有可控的安全性特征。
基于此研究结果,NMPA已受理CT041的新药上市申请,用于治疗Claudin18.2表达阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌(G/GEJA)患者。
易慕峰生物的纳米抗体靶向Claudin18.2的CAR-T疗法IMC002已启动III期确证性临床研究,用于既往接受过至少二线治疗的CLDN18.2表达阳性的不可手术局部晚期或转移性胃或胃食管结合部腺癌患者。
原启生物靶向GPC3的CAR-T药物Ori-C101在晚期肝细胞癌患者中展现出可控的安全性和持久疗效,DL3剂量组客观缓解率达100%,1例患者实现完全缓解。
02
体内CAR-T
今年CAR-T领域的交易,除了实体瘤CAR-T,体内CAR-T是另一个焦点。
由于细胞采集、体外扩增等复杂的制造流程,传统体外制备(ex vivo)的CAR-T药物往往一针动辄上百万,让许多患者望而却步。
体内CAR-T(in vivo CAR-T)的策略则打破了这一枷锁。该疗法通过病毒或纳米颗粒递送系统,将CAR基因直接注入患者体内,对T细胞“编程”为CAR-T细胞,有望显著缩短制备周期,实现“即时型”治疗,同时可以大幅降低成本和提高可及性。
根据药智数据,全球在研体内CAR-T项目已有超过10个进入临床试验阶段,其中不乏中国药企。
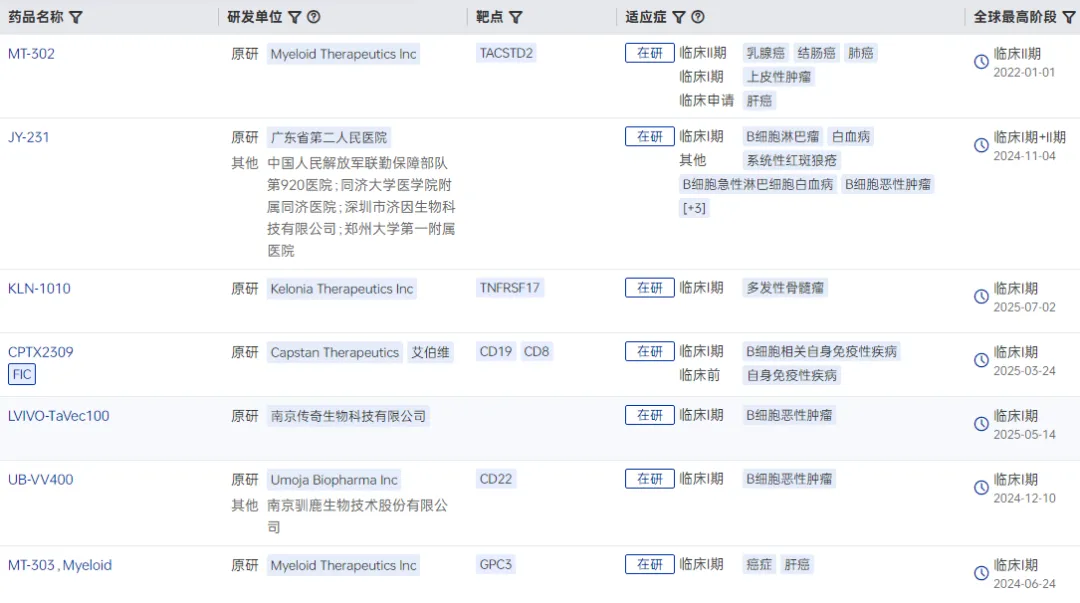
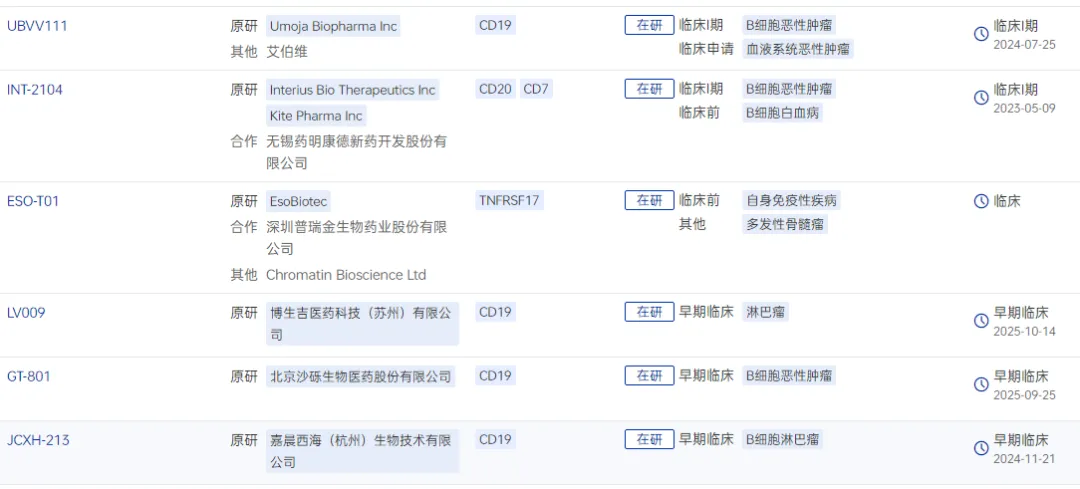
图1 临床阶段的体内CAR-T候选药物
图片来源:药智数据-全球药物分析系统
虽然体内CAR-T尚处于研发的早期阶段,但资本市场已敏锐捕捉到体内CAR-T的潜力。
一方面,4家体内CAR-T生物技术公司EsoBiotec、Capstan、Interius、Orbital先后被MNC收购。另一方面,体内CAR-T领域融资火热。
表1 体内CAR-T领域并购交易
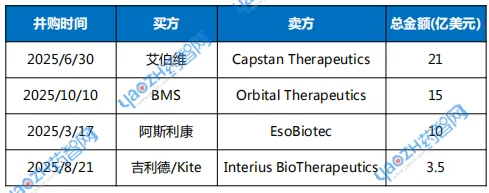
数据来源:根据公开资料整理
今年3月,阿斯利康率先开始了体内CAR-T布局,以高达10亿美元收购EsoBiotec。
该公司的BCMA靶向疗法ESO-T01采用第三代非复制型自失活慢病毒载体。在一项研究者发起试验中,ESO-T01对4例复发/难治性多发性骨髓瘤患者实现了100%的客观缓解率,其中2例达到严格完全缓解,且治疗前无需清淋化疗。
6月,另一家制药巨头艾伯维斥资21亿美元将Capstan Therapeutics收入麾下。
与EsoBiotec不同,Capstan采用的是靶向脂质纳米颗粒(tLNP)技术。公司核心管线是一款同类首创的抗CD19 CAR-T候选疗法CPTX2309。该药目前正处于临床1期研究,用于治疗B细胞介导的自身免疫性疾病。
8月,吉利德旗下Kite Pharma以3.5亿美元收购Interius。该公司的CD20产品INT2104是全球首个进入人体临床试验的体内CAR-T疗法。不过该药开发方向主要是B细胞肿瘤,目前未看到在自免领域的开发计划。
10月,Kite再次加码体内CAR-T领域布局,与普瑞金达成总额高达16.4亿美元的战略合作,双方将携手开发针对肿瘤、自身免疫性疾病的体内CAR-T疗法。据悉,阿斯利康收购的EsoBiotec公司就曾与普瑞金合作开发体内CAR-T疗法。
同样在10月,BMS以15亿美元现金收购了体内CAR-T公司Orbital Therapeutics。该公司目前还没有候选药物进入临床阶段,不过其CD19靶向CAR-T疗法OTX-201已处在IND申报阶段。该药不仅采用LNP技术,还结合了环状RNA(circRNA)编码CAR,比起传统线性mRNA,环状RNA结构更稳定,半衰期较长,可以实现更持久或更高水平的蛋白表达。
同时,体内CAR-T公司在融资市场活跃。
今年,锋寻生物、星锐医药、微滔生物等公司宣布完成融资,用于in vivo CAR-T细胞疗法的开发。
03
结语
经历多年发展,CAR-T疗法不再只是血液肿瘤的专属武器,它正演变为对抗实体瘤的利刃,甚至可能进军自身免疫疾病等更广阔的领域。而体内CAR-T疗法这一新模式,通过体内基因编辑,可简化生产、降低成本,有望让这项尖端技术惠及更多患者。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 22
22

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 20
20

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 20
20